Glucofaag voor de behandeling van diabetes
Merknaam: Glucophage
Algemene naam: metforminehydrochloride
Doseringsvorm: tabletten met verlengde afgifte
Inhoud:
Beschrijving
Klinische Farmacologie
Aanwijzingen en gebruik
Contra
waarschuwingen
Voorzorgsmaatregelen
Geneesmiddelinteracties
Bijwerkingen
Overdose
Dosering
Geleverde
Glucohage, metforminehydrochloride, patiëntinformatie (In gewoon Engels)
Beschrijving
Glucophage® (metforminehydrochloride) tabletten en Glucophage® XR (metforminehydrochloride) tabletten met verlengde afgifte zijn orale antihyperglycemische geneesmiddelen die worden gebruikt bij de behandeling van diabetes type 2. Metforminehydrochloride (N, N-dimethylimidodicarbonimidische diamidehydrochloride) is niet chemisch of farmacologisch gerelateerd aan andere klassen van orale antihyperglycemische middelen. De structuurformule is zoals weergegeven:
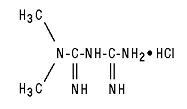
Metforminehydrochloride is een witte tot gebroken witte kristallijne verbinding met een molecuulformule van C4H11N5 - HCl en een molecuulgewicht van 165,63. Metforminehydrochloride is vrij oplosbaar in water en is praktisch onoplosbaar in aceton, ether en chloroform. De pKa van metformine is 12,4. De pH van een 1% waterige oplossing van metforminehydrochloride is 6,68.
Glucofaagtabletten bevatten 500 mg, 850 mg of 1000 mg metforminehydrochloride. Elke tablet bevat de inactieve ingrediënten povidon en magnesiumstearaat. Bovendien bevat de coating voor de tabletten van 500 mg en 850 mg hypromellose en de coating voor de tablet van 1000 mg bevat hypromellose en polyethyleenglycol.
Glucophage XR bevat 500 mg of 750 mg metforminehydrochloride als het actieve ingrediënt.
Glucofaag XR 500 mg tabletten bevatten de inactieve ingrediënten natriumcarboxymethylcellulose, hypromellose, microkristallijne cellulose en magnesiumstearaat.
Glucofaag XR 750 mg tabletten bevatten de inactieve ingrediënten natriumcarboxymethylcellulose, hypromellose en magnesiumstearaat.
Systeemcomponenten en Performance-Glucophage XR omvat een dubbel hydrofiel polymeer matrixsysteem. Metforminehydrochloride wordt gecombineerd met een geneesmiddelafgifte regelende polymeer om een "binnenste" fase te vormen, die vervolgens als afzonderlijke deeltjes wordt opgenomen in een "externe" fase van een tweede polymeer. Na toediening komt vloeistof uit het maagdarmkanaal de tablet binnen, waardoor de polymeren hydrateren en zwellen. Geneesmiddel wordt langzaam uit de doseringsvorm afgegeven door een diffusieproces door de gelmatrix die in wezen onafhankelijk is van de pH. Het gehydrateerde polymeersysteem is niet stijf en zal naar verwachting worden verbroken door normale peristaltiek in het maagdarmkanaal. De biologisch inerte componenten van de tablet kunnen soms intact blijven tijdens GI-doorvoer en zullen in de ontlasting worden geëlimineerd als een zachte, gehydrateerde massa.
top
Klinische Farmacologie
Werkingsmechanisme
Metformine is een antihyperglycemisch middel dat de glucosetolerantie verbetert bij patiënten met diabetes type 2, waardoor zowel basale als postprandiale plasmaglucose wordt verlaagd. De farmacologische werkingsmechanismen verschillen van andere klassen orale antihyperglycemische middelen. Metformine vermindert de glucoseproductie in de lever, vermindert de intestinale absorptie van glucose en verbetert de insulinegevoeligheid door de opname en het gebruik van perifere glucose te verhogen. In tegenstelling tot sulfonylurea veroorzaakt metformine geen hypoglykemie bij patiënten met diabetes type 2 of bij normale personen (behalve in speciale omstandigheden, zie VOORZORGSMAATREGELEN) en veroorzaakt geen hyperinsulinemie. Bij metformine-therapie blijft de insulinesecretie onveranderd, terwijl nuchtere insulinespiegels en de insulinerespons van een dag lang daadwerkelijk kunnen afnemen.
farmacokinetiek
Absorptie en biologische beschikbaarheid
De absolute biologische beschikbaarheid van een Glucophage 500 mg tablet gegeven onder nuchtere omstandigheden is ongeveer 50% tot 60%. Studies met enkelvoudige orale doses Glucophage 500 tot 1500 mg en 850 tot 2550 mg tonen aan dat er een tekort is aan dosisproportionaliteit met toenemende doses, die het gevolg is van verminderde absorptie in plaats van een wijziging in eliminatie. Voedsel vermindert de mate van en vertraagt de absorptie van metformine enigszins, zoals blijkt uit een ongeveer 40% lager gemiddeld piekplasma concentratie (Cmax), een 25% lager gebied onder de plasmaconcentratie versus tijdcurve (AUC), en een verlenging van 35 minuten van tijd tot piek plasmaconcentratie (Tmax) na toediening van een enkele tablet van 850 mg metformine met voedsel, vergeleken met dezelfde tabletsterkte toegediend vasten. De klinische relevantie van deze dalingen is onbekend.
Na een enkele orale dosis Glucophage XR wordt Cmax bereikt met een mediane waarde van 7 uur en een bereik van 4 tot 8 uur. Piekplasmaconcentraties zijn ongeveer 20% lager in vergelijking met dezelfde dosis glucofaag, maar de mate van absorptie (zoals gemeten met AUC) is vergelijkbaar met glucofaag.
In steady-state zijn de AUC en Cmax minder dan dosisproportioneel voor Glucophage XR binnen het bereik van 500 tot 2000 mg eenmaal daags toegediend. Piekplasmaconcentraties zijn ongeveer 0,6, 1,1, 1,4 en 1,8 µg / ml voor respectievelijk 500, 1000, 1500 en 2000 mg eenmaal daagse doses. De mate van metformine-absorptie (zoals gemeten door de AUC) van Glucophage XR bij een dosis van 2000 mg eenmaal daags is vergelijkbaar met dezelfde totale dagelijkse dosis die wordt toegediend als Glucophage tabletten 1000 mg tweemaal daags. Na herhaalde toediening van Glucophage XR accumuleerde metformine niet in plasma.
De variabiliteit binnen de patiënt in Cmax en AUC van metformine van Glucophage XR is vergelijkbaar met die van Glucophage.
Hoewel de mate van metformine-absorptie (zoals gemeten met AUC) van de Glucophage XR-tablet verhoogd met ongeveer 50% bij inname met voedsel, er was geen effect van voedsel op Cmax en Tmax van metformine. Zowel maaltijden met hoog als met laag vetgehalte hadden hetzelfde effect op de farmacokinetiek van Glucophage XR.
Distributie
Het schijnbare distributievolume (V / F) van metformine na een enkele orale dosis Glucophage 850 mg was gemiddeld 654 ± 358 L. Metformine is verwaarloosbaar gebonden aan plasma-eiwitten, in tegenstelling tot sulfonylurea, die voor meer dan 90% aan eiwitten zijn gebonden. Metformine verdeelt zich in erytrocyten, hoogstwaarschijnlijk als een functie van de tijd. Bij gebruikelijke klinische doses en doseringsschema's van glucofaag worden steady-state plasmaconcentraties van metformine binnen 24 tot 48 uur bereikt en zijn over het algemeen
Metabolisme en eliminatie
Intraveneuze onderzoeken met eenmalige dosis bij normale proefpersonen tonen aan dat metformine onveranderd wordt uitgescheiden in de urine en ondergaat geen metabolisme in de lever (geen metabolieten zijn geïdentificeerd bij de mens) noch gal excretie. Nierklaring (zie tafel 1) is ongeveer 3,5 keer groter dan de creatinineklaring, wat aangeeft dat tubulaire secretie de belangrijkste eliminatieroute is. Na orale toediening wordt ongeveer 90% van het geabsorbeerde geneesmiddel binnen de eerste 24 uur via de nierroute geëlimineerd, met een plasma-eliminatiehalfwaardetijd van ongeveer 6,2 uur. In bloed is de eliminatiehalfwaardetijd ongeveer 17,6 uur, wat suggereert dat de erytrocytmassa een verdelingscompartiment kan zijn.
Speciale populaties
Patiënten met diabetes type 2
In de aanwezigheid van een normale nierfunctie zijn er geen verschillen tussen de farmacokinetiek van metformine met één of meerdere doses tussen patiënten met diabetes type 2 en normale personen (zie tafel 1), noch is er accumulatie van metformine in beide groepen bij gebruikelijke klinische doses.
De farmacokinetiek van Glucophage XR bij patiënten met diabetes type 2 is vergelijkbaar met die bij gezonde normale volwassenen.
Nierinsufficiëntie
Bij patiënten met een verminderde nierfunctie (gebaseerd op gemeten creatinineklaring), zijn de plasma- en bloedhalfwaardetijd van metformine is verlengd en de renale klaring is afgenomen evenredig met de afname van de creatinineklaring (zie tafel 1; zie ook WAARSCHUWINGEN).
Leverinsufficiëntie
Er zijn geen farmacokinetische onderzoeken met metformine uitgevoerd bij patiënten met leverinsufficiëntie.
Geriatrie
Beperkte gegevens uit gecontroleerde farmacokinetische studies van glucofagen bij gezonde oudere personen suggereren dat totaal plasma de klaring van metformine is verminderd, de halfwaardetijd is verlengd en de Cmax is verhoogd in vergelijking met gezonde jongen onderwerpen. Uit deze gegevens blijkt dat de verandering in de farmacokinetiek van metformine met veroudering voornamelijk wordt verklaard door een verandering in de nierfunctie (zie tafel 1). Glucophage (metforminehydrochloride) tabletten en Glucophage XR (metforminehydrochloride) Tabletten met verlengde afgifte mogen niet worden geïnitieerd bij patiënten â ¥ 80 jaar oud, tenzij meting van de creatinineklaring aantoont dat de nierfunctie niet is verminderd (zien WAARSCHUWINGEN en DOSERING EN ADMINISTRATIE).
Tabel 1: Selecteer gemiddelde (± S.D.) farmacokinetische parameters van metformine na enkelvoudige of meervoudige orale doses glucofaag
| Onderwerpgroepen: Glucofaagdosiseen (aantal vakken) |
Cmaxb (µg / ml) |
Tmaxc (H) |
Nierklaring (Ml / min) |
|---|---|---|---|
| een Alle doses die nuchter zijn, behalve de eerste 18 doses van de onderzoeken met meerdere doses | |||
| b Piekplasmaconcentratie | |||
| c Tijd tot piekplasmaconcentratie | |||
| d Gecombineerde resultaten (gemiddelde gemiddelden) van vijf studies: gemiddelde leeftijd 32 jaar (bereik 23-59 jaar) | |||
| e Kinetisch onderzoek uitgevoerd na dosis 19, gegeven nuchter | |||
| f Oudere personen, gemiddelde leeftijd 71 jaar (bereik 65-81 jaar) | |||
| g CLcr = creatinineklaring genormaliseerd op lichaamsoppervlak van 1,73 m2 | |||
| Gezonde, niet-diabetische volwassenen: | |||
| 500 mg enkele dosis (24) | 1.03 ( ±0.33) | 2.75 ( ±0.81) | 600 ( ±132) |
| 850 mg enkele dosis (74)d | 1.60 ( ±0.38) | 2.64 ( ±0.82) | 552 ( ±139) |
| 850 mg driemaal daags gedurende 19 dosese (9) | 2.01 ( ±0.42) | 1.79 ( ±0.94) | 642 ( ±173) |
| Volwassenen met type 2 diabetes: | |||
| 850 mg enkele dosis (23) | 1.48 ( ±0.5) | 3.32 ( ±1.08) | 491 ( ±138) |
| 850 mg driemaal daags gedurende 19 dosese (9) | 1.90 ( ±0.62) | 2.01 ( ±1.22) | 550 ( ±160) |
| ouderenf, gezonde niet-diabetische volwassenen: | |||
| 850 mg enkele dosis (12) | 2.45 ( ±0.70) | 2.71 ( ±1.05) | 412 ( ±98) |
| Volwassenen met nierinsufficiëntie: | |||
| 850 mg enkele dosis | |||
| Mild (CLcrg 61-90 ml / min) (5) | 1.86 ( ±0.52) | 3.20 ( ±0.45) | 384 ( ±122) |
| Matig (CLcr 31-60 ml / min) (4) | 4.12 ( ±1.83) | 3.75 ( ±0.50) | 108 ( ±57) |
| Ernstig (CLcr 10-30 ml / min) (6) | 3.93 ( ±0.92) | 4.01 ( ±1.10) | 130 ( ±90 |
Kindergeneeskunde
Na toediening van een enkele orale Glucophage 500 mg tablet met voedsel, verschilden de geometrische gemiddelde metformine Cmax en AUC minder dan 5% tussen pediatrische type 2 diabetespatiënten (12-16 jaar oud) en geslacht en gewicht gematchte gezonde volwassenen (20-45 jaar oud), allemaal met normale nier functie
Geslacht
De farmacokinetische parameters van metformine verschilden niet significant tussen normale proefpersonen en patiënten met diabetes type 2 bij analyse op basis van geslacht (mannen = 19, vrouwen = 16). Evenzo was in gecontroleerde klinische onderzoeken bij patiënten met diabetes type 2 het antihyperglycemische effect van glucofaag vergelijkbaar bij mannen en vrouwen.
Ras
Er zijn geen onderzoeken naar farmacokinetische parameters van metformine volgens ras uitgevoerd. In gecontroleerde klinische onderzoeken naar glucofagen bij patiënten met diabetes type 2 was het antihyperglycemische effect vergelijkbaar bij blanken (n = 249), zwarten (n = 51) en hispanics (n = 24).
Klinische studies
Glucophage
In een dubbelblind, placebogecontroleerd, multicenter Amerikaans klinisch onderzoek met zwaarlijvige patiënten met diabetes type 2 bij wie hyperglykemie niet adequaat werd gecontroleerd met dieetbehandeling alleen (baseline nuchtere plasmaglucose [FPG] van ongeveer 240 mg / dL), behandeling met Glucophage (tot 2550 mg / dag) gedurende 29 weken resulteerde in significante gemiddelde netto reducties in nuchtere en postprandiale plasmaglucose (PPG) en hemoglobine A1c (HbA1c) met respectievelijk 59 mg / dL, 83 mg / dL en 1,8% in vergelijking met de placebogroep (zie Tafel 2).
Tabel 2: Glucofaag versus placebo Samenvatting van gemiddelde veranderingen ten opzichte van baseline * in nuchtere plasmaglucose, HbA1cen lichaamsgewicht bij het laatste bezoek (studie van 29 weken)
| Glucophage (N = 141) |
Placebo (N = 145) |
p-waarde | |
|---|---|---|---|
| * Alle patiënten op dieettherapie bij Baseline | ** Niet statistisch significant | ||
| FPG (mg / dL) Baseline Wijziging bij EINDBEZOEK |
241.5 -53.0 |
237.7 6.3 |
NS** 0.001 |
| Hemoglobine A1c (%) Baseline Wijziging bij EINDBEZOEK |
8.4 -1.4 |
8.2 0.4 |
NS** 0.001 |
| Lichaamsgewicht (lbs) Baseline Wijziging bij EINDBEZOEK |
201.0 -1.4 |
206.0 -2.4 |
NS** NS** |
Een dubbelblinde, placebogecontroleerde studie van 29 weken van glucofaag en glyburide, alleen en in combinatie, werd uitgevoerd bij obese patiënten met type 2 diabetes die onvoldoende glykemische controle had bereikt tijdens maximale doses glyburide (FPG bij aanvang van ongeveer 250 mg / dL) (zie tabel 3). Patiënten gerandomiseerd naar de combinatiearm begonnen met therapie met Glucophage 500 mg en glyburide 20 mg. Aan het einde van elke week van de eerste 4 weken van het onderzoek hadden deze patiënten hun doses Glucophage verhoogd met 500 mg als ze niet hadden bereikt dat ze de nuchtere plasmaglucose hadden bereikt. Na week 4 werden dergelijke dosisaanpassingen maandelijks uitgevoerd, hoewel geen enkele patiënt Glucophage 2500 mg mocht overschrijden. Patiënten in de Glucophage-arm (metformine plus placebo) volgden hetzelfde titratieschema. Aan het einde van het onderzoek gebruikte ongeveer 70% van de patiënten in de combinatiegroep Glucophage 2000 mg / glyburide 20 mg of Glucophage 2500 mg / glyburide 20 mg. Patiënten gerandomiseerd om door te gaan met glyburide ervoeren verslechtering van de glykemische controle, met gemiddelde verhogingen van FPG, PPG en HbA1c van respectievelijk 14 mg / dL, 3 mg / dL en 0,2%. Daarentegen vertoonden die gerandomiseerd naar Glucofaag (tot 2500 mg / dag) een lichte verbetering, met gemiddelde reducties in FPG, PPG en HbA1c van respectievelijk 1 mg / dL, 6 mg / dL en 0,4%. De combinatie van glucofaag en glyburide was effectief in het verlagen van FPG-, PPG- en HbA1c-niveaus met respectievelijk 63 mg / dl, 65 mg / dl en 1,7%. Vergeleken met alleen de resultaten van de behandeling met glyburide waren de netto verschillen met de combinatiebehandeling respectievelijk -77 mg / dl, -68 mg / dl en -1,9% (zie tabel 3).
Tabel 3: Gecombineerde Glucophage / Glyburide (Comb) versus Glyburide (Glyb) of Glucophage (GLU) Monotherapie: samenvatting van gemiddelde veranderingen ten opzichte van baseline * in nuchtere plasmaglucose, HbA1cen lichaamsgewicht bij het laatste bezoek (studie van 29 weken)
| p-waarden | ||||||
|---|---|---|---|---|---|---|
| Kam (N = 213) |
Glyb (N = 209) |
GLU (N = 210) |
Glyb vs Kam |
GLU versus Kam |
GLU versus Glyb |
|
| * Alle patiënten op glyburide, 20 mg / dag, op baseline | ** Niet statistisch significant | |||||
| Vastende plasmaglucose (mg / dL) | ||||||
| Baseline Wijziging bij EINDBEZOEK |
250.5 -63.5 |
247.5 13.7 |
253.9 -0.9 |
NS** 0.001 |
NS** 0.001 |
NS** 0.025 |
| Hemoglobine A1c (%) | ||||||
| Baseline Wijziging bij EINDBEZOEK |
8.8 -1.7 |
8.5 0.2 |
8.9 -0.4 |
NS** 0.001 |
NS** 0.001 |
0.007 0.001 |
| Lichaamsgewicht (lbs) | ||||||
| Baseline Wijziging bij EINDBEZOEK |
202.2 0.9 |
203.0 -0.7 |
204.0 -8.4 |
NS** 0.011 |
NS** 0.001 |
NS** 0.001 |
De omvang van de daling van de nuchtere bloedglucoseconcentratie na de instelling van De therapie met glucofagen (metforminehydrochloride) was evenredig met het niveau van vasten hyperglykemie. Patiënten met type 2 diabetes met hogere nuchtere glucoseconcentraties ondervonden grotere dalingen van plasmaglucose en geglycosyleerd hemoglobine.
In klinische onderzoeken verlaagde glucofaag, alleen of in combinatie met een sulfonylureum, het gemiddelde nuchtere serum triglyceriden, totaal cholesterol en LDL-cholesterolwaarden, en hadden geen nadelige effecten op andere lipideniveaus (zie Tabel 4).
Tabel 4: Samenvatting van de gemiddelde procentuele verandering ten opzichte van de uitgangswaarde van belangrijke serumlipidevariabelen bij het laatste bezoek (studies van 29 weken)
| Glucofaag versus Placebo | Gecombineerde glucofaag / glyburide versus monotherapie |
||||
|---|---|---|---|---|---|
| Glucophage (N = 141) |
Placebo (N = 145) |
Glucophage (N = 210) |
Glucophage / glyburide (N = 213) |
glyburide (N = 209) |
|
| Totaal cholesterol (mg / dL) | |||||
| Baseline Gemiddeld% verandering bij EIND BEZOEK |
211.0 -5% |
212.3 1% |
213.1 -2% |
215.6 -4% |
219.6 1% |
| Totaal triglyceriden (mg / dL) | |||||
| Baseline Gemiddeld% verandering bij EIND BEZOEK |
236.1 -16% |
203.5 1% |
242.5 -3% |
215.0 -8% |
266.1 4% |
| LDL-cholesterol (mg / dL) | |||||
| Baseline Gemiddeld% verandering bij EIND BEZOEK |
135.4 -8% |
138.5 1% |
134.3 -4% |
136.0 -6% |
137.5 3% |
| HDL-cholesterol (mg / dL) | |||||
| Baseline Gemiddeld% verandering bij EIND BEZOEK |
39.0 2% |
40.5 -1% |
37.2 5% |
39.0 3% |
37.0 1% |
In tegenstelling tot sulfonylureumderivaten, bleef het lichaamsgewicht van personen op glucofaag vaak stabiel of daalde zelfs enigszins (zie Tabellen 2 en 3).
Een 24-weken durende, dubbelblinde, placebo-gecontroleerde studie van Glucophage plus insuline versus insuline plus placebo was uitgevoerd bij patiënten met diabetes type 2 die onvoldoende glycemische controle op insuline alleen bereikten (zie Tabel 5). Patiënten gerandomiseerd om Glucophage plus insuline te ontvangen, bereikten een HbA1c-reductie van 2,10%, vergeleken met een reductie van 1,56% in HbA1c door insuline plus placebo. De verbetering van de glykemische controle werd bereikt tijdens het laatste studiebezoek met respectievelijk 16% minder insuline, 93,0 U / dag versus 110,6 U / dag, glucofaag plus insuline versus insuline plus placebo, p = 0,04.
Tabel 5: Gecombineerde glucofaag / insuline versus placebo / insuline Samenvatting van gemiddelde veranderingen ten opzichte van de uitgangswaarde in HbA1c en dagelijkse insulinedosis
| Glucophage / Insuline (N = 26) |
Placebo/ Insuline (N = 28) |
Behandeling Verschil Gemiddelde ± SE |
|
|---|---|---|---|
|
een Statistisch significant met behulp van analyse van covariantie met baseline als covariate (p = 0,04) Niet significant met variantieanalyse (waarden weergegeven in tabel) | |||
| b Statistisch significant voor insuline (p = 0,04) | |||
| Hemoglobine A1c (%) | |||
| Baseline Wijziging bij EINDBEZOEK |
8.95 -2.10 |
9.32 -1.56 |
-0.54 ± 0.43een |
| Insulinedosis (U / dag) | |||
| Baseline Wijziging bij EINDBEZOEK |
93.12 -0.15 |
94.64 15.93 |
-16.08 ± 7.77b |
Een tweede dubbelblind, placebo-gecontroleerd onderzoek (n = 51), met 16 weken gerandomiseerde behandeling, toonde aan dat bij patiënten met type 2 diabetes gedurende 8 weken insuline onder controle kreeg met een gemiddelde HbA1c van 7,46 ± 0,97% handhaafde de toevoeging van Glucophage een vergelijkbare glycemische controle (HbA1c 7,15 ± 0,61 versus 6,97 ± 0,62 voor Glucophage plus insuline en placebo plus insuline respectievelijk) met 19% minder insuline ten opzichte van de uitgangswaarde (reductie van 23,68 ± 30,22 versus een toename van 0,43 ± 25,20 eenheden voor Glucophage plus insuline en placebo plus insuline, p <0,01). Bovendien toonde deze studie aan dat de combinatie van glucofaag plus insuline resulteerde in reductie in lichaamsgewicht van 3,11 ± 4,30 lbs, vergeleken met een toename van 1,30 ± 6,08 lbs voor placebo plus insuline, p = 0,01.
Glucofaag XR
Een 24-weken durende, dubbelblinde, placebo-gecontroleerde studie van Glucophage XR, eenmaal daags genomen bij het avondeten, werd uitgevoerd in patiënten met diabetes type 2 die de glykemische controle met dieet en lichaamsbeweging niet hadden bereikt (HbA1c 7,0% -10,0%, FPG 126-270 mg / dL). Patiënten die aan het onderzoek deelnamen, hadden een gemiddelde baseline HbA1c van 8,0% en een gemiddelde baseline FPG van 176 mg / dL. Na 12 weken behandeling was het gemiddelde HbA1c vanaf de uitgangswaarde met 0,1% gestegen en was de gemiddelde FPG vanaf de uitgangswaarde met 2 mg / dl afgenomen in de placebogroep, vergeleken met een afname van de gemiddelde HbA1c van 0,6% en een afname van de gemiddelde FPG van 23 mg / dL bij patiënten die eenmaal werden behandeld met 1000 mg Glucophage XR 1000 mg dagelijks. Vervolgens werd de behandelingsdosis verhoogd tot 1500 mg eenmaal daags als HbA1c ‰ ¥ 7,0% maar <8,0% was (patiënten met HbA1c â ‰ ¥ 8,0% werden uit het onderzoek gestaakt). Bij het laatste bezoek (24 weken) was de gemiddelde HbA1c 0,2% gestegen ten opzichte van de uitgangswaarde bij placebopatiënten en daalde 0,6% met Glucophage XR.
Een dubbelblind, placebo-gecontroleerd, dosis-responsonderzoek van 16 weken van Glucophage XR, eenmaal daags bij het avondmaal of tweemaal daags bij de maaltijd, werd uitgevoerd bij patiënten met diabetes type 2 die de glykemische controle met dieet en lichaamsbeweging niet hadden bereikt (HbA1c 7,0% -11,0%, FPG 126-280 mg / dL). Veranderingen in glycemische controle en lichaamsgewicht worden weergegeven in tabel 6.
Tabel 6: Samenvatting van gemiddelde veranderingen ten opzichte van baseline * in HbA1c, Nuchtere plasmaglucose en lichaamsgewicht bij het laatste bezoek (onderzoek van 16 weken)
| Glucofaag XR | Placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg Een keer Dagelijks |
1000 mg Een keer Dagelijks |
1500 mg Een keer Dagelijks |
2000 mg Een keer Dagelijks |
1000 mg Tweemaal Dagelijks |
||
| * Alle patiënten op dieettherapie bij Baseline | ||||||
| een Alle vergelijkingen versus Placebo | ||||||
| ** Niet statistisch significant | ||||||
| Hemoglobine A1c (%) | (N = 115) | (N = 115) | (N = 111) | (N = 125) | (N = 112) | (N = 111) |
| Baseline | 8.2 | 8.4 | 8.3 | 8.4 | 8.4 | 8.4 |
| Wijziging bij EINDBEZOEK | -0.4 | -0.6 | -0.9 | -0.8 | -1.1 | 0.1 |
| p-valueeen | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| FPG (mg / dL) | (N = 126) | (N = 118) | (N = 120) | (N = 132) | (N = 122) | (N = 113) |
| Baseline | 182.7 | 183.7 | 178.9 | 181.0 | 181.6 | 179.6 |
| Wijziging bij EINDBEZOEK | -15.2 | -19.3 | -28.5 | -29.9 | -33.6 | 7.6 |
| p-valueeen | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| Lichaamsgewicht (lbs) | (N = 125) | (N = 119) | (N = 117) | (N = 131) | (N = 119) | (N = 113) |
| Baseline | 192.9 | 191.8 | 188.3 | 195.4 | 192.5 | 194.3 |
| Wijziging bij EINDBEZOEK | -1.3 | -1.3 | -0.7 | -1.5 | -2.2 | -1.8 |
| p-valueeen | NS** | NS** | NS** | NS** | NS** | - |
In vergelijking met placebo werd verbetering van de glykemische controle waargenomen bij alle dosisniveaus van Glucophage XR (metformine hydrochloride) Tabletten met verlengde afgifte en behandeling was niet geassocieerd met enige significante verandering in gewicht (zien DOSERING EN ADMINISTRATIE voor doseringsaanbevelingen voor Glucophage en Glucophage XR).
Een 24-weken durende, dubbelblinde, gerandomiseerde studie van Glucophage XR, eenmaal daags bij het avondmaal, en Glucophage (metforminehydrochloride) tabletten, tweemaal daags (met ontbijt en avondmaaltijd), werd uitgevoerd bij patiënten met diabetes type 2 die gedurende minstens 8 weken vóór aanvang van de studie tweemaal daags met Glucophage 500 mg tweemaal daags waren behandeld. De dosis Glucofaag was niet noodzakelijkerwijs getitreerd om een specifiek niveau van glycemische controle te bereiken voorafgaand aan de studie. Patiënten kwamen in aanmerking voor de studie als HbA1c was â ‰ ¤ 8,5% en FPG was â ‰ ¤ 200 mg / dL. Veranderingen in glycemische controle en lichaamsgewicht worden weergegeven in tabel 7.
Tabel 7: Samenvatting van gemiddelde veranderingen ten opzichte van baseline * in HbA1c, Nuchtere plasmaglucose en lichaamsgewicht in week 12 en tijdens het laatste bezoek (24 weken durende studie)
| Glucophage 500 mg Tweemaal daags |
Glucofaag XR | ||
|---|---|---|---|
| 1000 mg Een keer per dag |
1500 mg Een keer per dag |
||
| * Alle patiënten op Glucophage 500 mg tweemaal daags bij baseline | |||
| een n = 68 | |||
| Hemoglobine A1c (%) | (N = 67) | (N = 72) | (N = 66) |
| Baseline | 7.06 | 6.99 | 7.02 |
| Wissel na 12 weken | 0.14 | 0.23 | 0.04 |
| (95% BI) | (-0.03, 0.31) | (0.10, 0.36) | (-0.08, 0.15) |
| Wijziging bij EINDBEZOEK | 0.14een | 0.27 | 0.13 |
| (95% BI) | (-0.04, 0.31) | (0.11, 0.43) | (-0.02, 0.28) |
| FPG (mg / dL) | (N = 69) | (N = 72) | (N = 70) |
| Baseline | 127.2 | 131.0 | 131.4 |
| Wissel na 12 weken | 12.9 | 9.5 | 3.7 |
| (95% BI) | (6.5, 19.4) | (4.4, 14.6) | (-0.4, 7.8) |
| Wijziging bij EINDBEZOEK | 14.0 | 11.5 | 7.6 |
| (95% BI) | (7.0, 21.0) | (4.4, 18.6) | (1.0, 14.2) |
| Lichaamsgewicht (lbs) | (N = 71) | (N = 74) | (N = 71) |
| Baseline | 210.3 | 202.8 | 192.7 |
| Wissel na 12 weken | 0.4 | 0.9 | 0.7 |
| (95% BI) | (-0.4, 1.5) | (0.0, 2.0) | (-0.4, 1.8) |
| Wijziging bij EINDBEZOEK | 0.9 | 1.1 | 0.9 |
| (95% BI) | (-0.4, 2.2) | (-0.2, 2.4) | (-0.4, 2.0) |
Na 12 weken behandeling was er een toename van de gemiddelde HbA1c in alle groepen; in de Glucophage XR 1000 mg-groep was de stijging ten opzichte van de uitgangswaarde van 0,23% statistisch significant (zie DOSERING EN ADMINISTRATIE).
Veranderingen in lipideparameters in het eerder beschreven placebo-gecontroleerde dosis-responsonderzoek van Glucophage XR worden getoond in tabel 8.
Tabel 8: Samenvatting van gemiddelde procentuele veranderingen ten opzichte van baseline * in belangrijke lipidevariabelen bij laatste bezoek (onderzoek van 16 weken)
| Glucofaag XR | Placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg Een keer Dagelijks |
1000 mg Een keer Dagelijks |
1500 mg Een keer Dagelijks |
2000 mg Een keer Dagelijks |
1000 mg Tweemaal Dagelijks |
||
| * Alle patiënten op dieettherapie bij Baseline | ||||||
| Totaal cholesterol (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| Baseline | 210.3 | 218.1 | 214.6 | 204.4 | 208.2 | 208.6 |
| Gemiddeld% verandering bij EIND BEZOEK | 1.0% | 1.7% | 0.7% | -1.6% | -2.6% | 2.6% |
| Totaal triglyceriden (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| Baseline | 220.2 | 211.9 | 198.0 | 194.2 | 179.0 | 211.7 |
| Gemiddeld% verandering bij EIND BEZOEK | 14.5% | 9.4% | 15.1% | 14.9% | 9.4% | 10.9% |
| LDL-cholesterol (mg / dL) | (N = 119) | (N = 113) | (N = 109) | (N = 126) | (N = 117) | (N = 107) |
| Baseline | 131.0 | 134.9 | 135.8 | 125.8 | 131.4 | 131.9 |
| Gemiddeld% verandering bij EIND BEZOEK | -1.4% | -1.6% | -3.5% | -3.3% | -5.5% | 3.2% |
| HDL-cholesterol (mg / dL) | (N = 120) | (N = 108) | (N = 108) | (N = 125) | (N = 117) | (N = 108) |
| Baseline | 40.8 | 41.6 | 40.6 | 40.2 | 42.4 | 39.4 |
| Gemiddeld% verandering bij EIND BEZOEK | 6.2% | 8.6% | 5.5% | 6.1% | 7.1% | 5.8% |
Veranderingen in lipideparameters in de eerder beschreven studie van Glucophage en Glucophage XR worden getoond in Tabel 9.
Tabel 9: Samenvatting van gemiddelde procentuele veranderingen ten opzichte van baseline * in belangrijke lipidevariabelen bij eindbezoek (onderzoek van 24 weken)
| Glucophage | Glucofaag XR | ||
|---|---|---|---|
| 500 mg Tweemaal daags |
1000 mg Een keer per dag |
1500 mg Een keer per dag |
|
| * Alle patiënten op Glucophage 500 mg tweemaal daags bij baseline | |||
| Totaal cholesterol (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 199.0 | 201.9 | 201.6 |
| Gemiddeld% verandering bij EIND BEZOEK | 0.1% | 1.3% | 0.1% |
| Totaal triglyceriden (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 178.0 | 169.2 | 206.8 |
| Gemiddeld% verandering bij EIND BEZOEK | 6.3% | 25.3% | 33.4% |
| LDL-cholesterol (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 122.1 | 126.2 | 115.7 |
| Gemiddeld% verandering bij EIND BEZOEK | −1.3% | −3.3% | −3.7% |
| HDL-cholesterol (mg / dL) | (N = 68) | (N = 70) | (N = 65) |
| Baseline | 41.9 | 41.7 | 44.6 |
| Gemiddeld% verandering bij EIND BEZOEK | 4.8% | 1.0% | -2.1% |
Pediatrische klinische studies
In een dubbelblind, placebogecontroleerd onderzoek bij pediatrische patiënten in de leeftijd van 10 tot 16 jaar met diabetes type 2 (gemiddelde FPG 182,2 mg / dL), behandeling met glucofaag (tot 2000 mg / dag) gedurende maximaal 16 weken (gemiddelde behandelingsduur 11 weken) resulteerde in een significante gemiddelde netto reductie in FPG van 64,3 mg / dL, vergeleken met placebo (zie tabel 10).
Tabel 10: Glucofaag versus Placebo (Kindergeneeskundeeen) Samenvatting van gemiddelde veranderingen ten opzichte van baseline * in plasmaglucose en lichaamsgewicht bij laatste bezoek
| Glucophage | Placebo | p-waarde | |
|---|---|---|---|
| een Pediatrische patiënten gemiddelde leeftijd 13,8 jaar (bereik 10-16 jaar) | |||
| * Alle patiënten op dieettherapie bij Baseline | |||
| ** Niet statistisch significant | |||
| FPG (mg / dL) | (N = 37) | (N = 36) | |
| Baseline Wijziging bij EINDBEZOEK |
162.4 -42.9 |
192.3 21.4 |
<0.001 |
| Lichaamsgewicht (lbs) | (N = 39) | (N = 38) | |
| Baseline Wijziging bij EINDBEZOEK |
205.3 -3.3 |
189.0 -2.0 |
NS** |
top
Aanwijzingen en gebruik
Glucofaag (metforminehydrochloride) Tabletten is geïndiceerd als aanvulling op dieet en lichaamsbeweging om de glykemische controle bij volwassenen en kinderen met diabetes mellitus type 2 te verbeteren.
Glucofaag XR (metforminehydrochloride) Tabletten met verlengde afgifte is geïndiceerd als aanvulling op dieet en lichaamsbeweging om de glykemische controle bij volwassenen met diabetes mellitus type 2 te verbeteren.
top
Contra
Glucophage en Glucophage XR zijn gecontra-indiceerd bij patiënten met:
Nierziekte of nierdisfunctie (bijv. Zoals gesuggereerd door serumcreatininespiegels â ‰ ¥ 1,5 mg / dL [mannen], â ‰ ¥ 1,4 mg / dL [vrouwen] of abnormaal creatinineklaring) die ook het gevolg kan zijn van aandoeningen zoals cardiovasculaire collaps (shock), acuut myocardinfarct en septikemie (zien WAARSCHUWINGEN en VOORZORGSMAATREGELEN).
Bekende overgevoeligheid voor metforminehydrochloride.
Acute of chronische metabole acidose, inclusief diabetische ketoacidose, met of zonder coma. Diabetische ketoacidose moet worden behandeld met insuline.
Glucofaag en Glucofaag XR moeten tijdelijk worden stopgezet bij patiënten die radiologische onderzoeken ondergaan waarbij betrokken is intravasculaire toediening van gejodeerde contrastmaterialen, omdat het gebruik van dergelijke producten kan leiden tot acute verandering van nierfunctie. (Zie ook VOORZORGSMAATREGELEN.)
top
waarschuwingen
Melkzuur acidose:
Lactaatacidose is een zeldzame, maar ernstige, metabole complicatie die kan optreden als gevolg van accumulatie van metformine tijdens behandeling met Glucophage of Glucophage XR; wanneer het optreedt, is het in ongeveer 50% van de gevallen dodelijk. Lactaatacidose kan ook optreden in combinatie met een aantal pathofysiologische aandoeningen, waaronder diabetes mellitus, en wanneer er sprake is van significante weefselhypoperfusie en hypoxemie. Lactaatacidose wordt gekenmerkt door verhoogde bloedlactaatspiegels (> 5 mmol / L), verlaagde bloed-pH, elektrolytstoornissen met een verhoogde anion gap en een verhoogde lactaat / pyruvaat-verhouding. Wanneer metformine als oorzaak van lactaatacidose wordt betrokken, worden metformine-plasmaspiegels> 5 µg / ml in het algemeen gevonden.
De gerapporteerde incidentie van lactaatacidose bij patiënten die metforminehydrochloride krijgen, is zeer laag (ongeveer 0,03 gevallen / 1000 patiëntjaren, met ongeveer 0,015 fatale gevallen / 1000 patiëntjaren). In klinische onderzoeken van meer dan 20.000 patiëntjaren aan metformine waren er geen meldingen van lactaatacidose. Gemelde gevallen zijn voornamelijk opgetreden bij diabetespatiënten met significante nierinsufficiëntie, inclusief beide intrinsieke nier ziekte en renale hypoperfusie, vaak in de context van meerdere bijkomende medische / chirurgische problemen en meerdere gelijktijdige medicijnen. Patiënten met congestief hartfalen die farmacologisch beheer vereisen, in het bijzonder patiënten met onstabiel of acuut congestief hartfalen met een risico op hypoperfusie en hypoxemie, hebben een verhoogd risico op melkzuur acidose. Het risico op lactaatacidose neemt toe met de mate van nierdisfunctie en de leeftijd van de patiënt. Het risico op lactaatacidose kan daarom aanzienlijk worden verminderd door regelmatige controle van de nierfunctie in patiënten die Glucophage of Glucophage XR gebruiken en met behulp van de minimale effectieve dosis Glucophage of Glucophage XR. In het bijzonder moet de behandeling van ouderen gepaard gaan met een zorgvuldige controle van de nierfunctie. Behandeling met Glucofaag of Glucofaag XR dient niet te worden gestart bij patiënten van ≥ 80 jaar oud, tenzij meting van creatinine klaring toont aan dat de nierfunctie niet wordt verminderd, omdat deze patiënten gevoeliger zijn voor het ontwikkelen van melkzuur acidose. Glucophage en Glucophage XR moeten bovendien onmiddellijk worden onthouden in aanwezigheid van een aandoening geassocieerd met hypoxemie, uitdroging of sepsis. Omdat een verminderde leverfunctie het vermogen om lactaat, glucofaag en te wissen aanzienlijk kan beperken Glucofaag XR moet in het algemeen worden vermeden bij patiënten met klinische of laboratoriumgegevens van lever ziekte. Patiënten moeten worden gewaarschuwd tegen overmatige alcoholinname, hetzij acuut of chronisch, bij het nemen Glucofaag of Glucofaag XR, omdat alcohol de effecten van metforminehydrochloride op lactaat versterkt metabolisme. Bovendien moeten Glucophage en Glucophage XR tijdelijk worden stopgezet voorafgaand aan een intravasculair radiocontrastonderzoek en voor elke chirurgische procedure (zie ook VOORZORGSMAATREGELEN).
Het begin van lactaatacidose is vaak subtiel en gaat alleen gepaard met niet-specifieke symptomen zoals malaise, myalgie, ademnood, toenemende slaperigheid en niet-specifieke buikpijn. Er kunnen hypothermie, hypotensie en resistente bradyaritmieën geassocieerd zijn met duidelijkere acidose. De patiënt en de arts van de patiënt moeten zich bewust zijn van het mogelijke belang van dergelijke symptomen en de patiënt moet de instructie krijgen om de arts onmiddellijk op de hoogte te stellen als ze zich voordoen (zie ook VOORZORGSMAATREGELEN). Glucophage en Glucophage XR moeten worden ingetrokken totdat de situatie is opgehelderd. Serumelektrolyten, ketonen, bloedglucose en, indien aangegeven, bloed-pH, lactaatniveaus en zelfs bloedmetforminespiegels kunnen nuttig zijn. Als een patiënt eenmaal is gestabiliseerd op een dosisniveau van Glucophage of Glucophage XR, is het onwaarschijnlijk dat gastro-intestinale symptomen, die vaak optreden tijdens het starten van de therapie, gerelateerd zijn aan het geneesmiddel. Later optreden van gastro-intestinale symptomen kan te wijten zijn aan lactaatacidose of een andere ernstige ziekte.
Niveaus van nuchtere veneuze plasmalactaat boven de bovengrens van normaal, maar minder dan 5 mmol / L bij patiënten die Glucophage of Glucophage XR gebruiken, hoeven niet noodzakelijkerwijs aan te geven dreigende lactaatacidose en kan worden verklaard door andere mechanismen, zoals slecht gereguleerde diabetes of obesitas, krachtige lichamelijke activiteit of technische problemen in het monster handling. (Zie ook VOORZORGSMAATREGELEN.)
Lactaatacidose moet worden vermoed bij elke diabetespatiënt met metabole acidose zonder bewijs van ketoacidose (ketonurie en ketonemie).
Lactaatacidose is een medisch noodgeval dat in een ziekenhuisomgeving moet worden behandeld. Bij een patiënt met lactaatacidose die Glucophage of Glucophage XR gebruikt, moet het medicijn onmiddellijk worden gestaakt en moeten onmiddellijk algemene ondersteunende maatregelen worden ingesteld. Omdat metforminehydrochloride dialyseerbaar is (met een klaring tot 170 ml / min bij goede hemodynamische eigenschappen) omstandigheden), wordt snelle hemodialyse aanbevolen om de acidose te corrigeren en de opgehoopte te verwijderen metformine. Dergelijk beheer resulteert vaak in een onmiddellijke omkering van symptomen en herstel. (Zie ook CONTRA en VOORZORGSMAATREGELEN.)
top
Voorzorgsmaatregelen
Algemeen
Macrovasculaire uitkomsten — Er zijn geen klinische onderzoeken geweest die overtuigend bewijs van macrovasculaire risicoreductie met Glucophage of Glucophage XR of enig ander antidiabetisch geneesmiddel hebben vastgesteld.
Monitoring van de nierfunctie - Van metformine is bekend dat het substantieel wordt uitgescheiden door de nier, en de het risico op accumulatie van metformine en lactaatacidose neemt toe met de mate van nierinsufficiëntie functie. Patiënten met serumcreatininespiegels boven de normale bovengrens voor hun leeftijd mogen dus geen Glucophage of Glucophage XR krijgen. Bij patiënten met gevorderde leeftijd moeten Glucophage en Glucophage XR zorgvuldig worden getitreerd om vast te stellen de minimale dosis voor een adequaat glycemisch effect, omdat veroudering gepaard gaat met een verminderde nierfunctie functie. Bij oudere patiënten, vooral die â ¥ 80 jaar oud, moet de nierfunctie regelmatig worden gecontroleerd en in het algemeen mogen Glucophage en Glucophage XR niet worden getitreerd tot de maximale dosis (zie WAARSCHUWINGEN en DOSERING EN ADMINISTRATIE).
Voor aanvang van de behandeling met Glucophage of Glucophage XR en ten minste jaarlijks daarna moet de nierfunctie worden beoordeeld en geverifieerd als normaal. Bij patiënten bij wie de ontwikkeling van nierdisfunctie wordt verwacht, moet de nierfunctie worden beoordeeld vaker en Glucophage of Glucophage XR stopgezet als er aanwijzingen zijn voor nierinsufficiëntie Cadeau.
Gebruik van gelijktijdig toegediende medicijnen die de nierfunctie of metformine-dispositie kunnen beïnvloeden - Gelijktijdige medicatie (s) die de nierfunctie kunnen beïnvloeden of kunnen resulteren in significante hemodynamische verandering of kan interfereren met de dispositie van metformine, zoals kationische geneesmiddelen die worden geëlimineerd door renale tubulaire secretie (zie VOORZORGSMAATREGELEN: Geneesmiddelinteracties), moet met voorzichtigheid worden gebruikt.
Radiologische studies waarbij intravasculaire gejodeerde contrastmaterialen worden gebruikt (bijvoorbeeld intraveneus urogram, intraveneus cholangiografie, angiografie en computertomografie (CT) scans met intravasculaire contrastmaterialen) —Intravasculaire contraststudies met gejodeerde materialen kunnen leiden tot acute verandering van de nierfunctie en zijn in verband gebracht met lactaatacidose bij patiënten die behandeld worden metformine (zie CONTRA). Daarom moet bij patiënten bij wie een dergelijk onderzoek is gepland, Glucophage of Glucophage XR tijdelijk worden stopgezet op het moment van of voorafgaand aan de procedure, en 48 uur na de procedure onthouden en alleen hersteld nadat de nierfunctie opnieuw is geëvalueerd en is bevonden normaal.
Hypoxische toestanden - Cardiovasculaire collaps (shock) door welke oorzaak dan ook, acuut congestief hartfalen, acuut myocardiaal infarct en andere aandoeningen gekenmerkt door hypoxemie zijn in verband gebracht met lactaatacidose en kunnen ook veroorzaken prerenale azotemie. Wanneer dergelijke bijwerkingen optreden bij patiënten die Glucophage of Glucophage XR-therapie krijgen, moet het medicijn onmiddellijk worden stopgezet.
Chirurgische ingrepen — Glucofaag of Glucofaag XR-therapie moet tijdelijk worden opgeschort voor elke chirurgische ingreep (behalve kleine ingrepen die niet zijn geassocieerd met beperkte inname van voedsel en vloeistoffen) en mag niet opnieuw worden gestart totdat de orale inname van de patiënt is hervat en de nierfunctie is geëvalueerd als normaal.
Alcoholinname - Van alcohol is bekend dat het het effect van metformine op het lactaatmetabolisme versterkt. Patiënten moeten daarom worden gewaarschuwd voor overmatige alcoholinname, acuut of chronisch, tijdens het gebruik van Glucophage of Glucophage XR.
Verminderde leverfunctie - Aangezien een verminderde leverfunctie is geassocieerd met sommige gevallen van lactaatacidose, Glucofaag en Glucofaag XR moeten in het algemeen worden vermeden bij patiënten met klinische of laboratoriumgegevens van lever ziekte.
Vitamine B12-waarden - In gecontroleerde klinische onderzoeken met Glucofaag met een duur van 29 weken, een afname tot subnormale niveaus van voorheen werden normale serum-vitamine B12-waarden, zonder klinische manifestaties, waargenomen bij ongeveer 7% van patiënten. Een dergelijke afname, mogelijk als gevolg van interferentie met B12-absorptie door het B12-intrinsieke factorcomplex, is echter zeer zelden geassocieerd met bloedarmoede en lijkt snel omkeerbaar te zijn bij stopzetting van glucofaag of vitamine B12 aanvulling. Het meten van hematologische parameters op jaarbasis wordt geadviseerd bij patiënten die Glucophage of Glucophage XR gebruiken en alle zichtbare afwijkingen moeten naar behoren worden onderzocht en beheerd (zie VOORZORGSMAATREGELEN: Laboratorium testen).
Bepaalde personen (personen met onvoldoende vitamine B12 of calciuminname of -absorptie) blijken vatbaar te zijn voor het ontwikkelen van subnormale vitamine B12-waarden. Bij deze patiënten kunnen routinematige serum-vitamine B12-metingen met tussenpozen van 2 tot 3 jaar nuttig zijn.
Verandering in klinische status van patiënten met eerder gecontroleerde diabetes type 2 — Een patiënt met diabetes type 2 die eerder goed onder controle stond met Glucophage of Glucophage XR die ontwikkelt laboratoriumafwijkingen of klinische ziekten (vooral vage en slecht gedefinieerde ziekten) moeten onmiddellijk worden geëvalueerd op aanwijzingen voor ketoacidose of melkzuur acidose. Evaluatie moet serumelektrolyten en ketonen, bloedglucose en, indien aangegeven, bloed-pH, lactaat, pyruvaat en metforminewaarden omvatten. Als acidose in beide vormen optreedt, moet Glucophage of Glucophage XR onmiddellijk worden gestopt en moeten andere passende corrigerende maatregelen worden genomen (zie ook WAARSCHUWINGEN).
Hypoglykemie — Hypoglykemie komt niet voor bij patiënten die alleen onder normale gebruiksomstandigheden Glucophage of Glucophage XR krijgen, maar kan optreden wanneer calorie-inname tekort, wanneer zware inspanning niet wordt gecompenseerd door calorische suppletie of tijdens gelijktijdig gebruik met andere glucoseverlagende middelen (zoals sulfonylureumderivaten en insuline) of ethanol.
Oudere, verzwakte of ondervoede patiënten en patiënten met bijnier- of hypofyse-insufficiëntie of alcoholintoxicatie zijn bijzonder gevoelig voor hypoglycemische effecten. Hypoglykemie kan moeilijk te herkennen zijn bij ouderen en bij mensen die bèta-adrenerge blokkerende geneesmiddelen gebruiken.
Verlies van controle over bloedglucose — Wanneer een patiënt gestabiliseerd op een diabetisch regime wordt blootgesteld aan stress zoals koorts, trauma, infectie of chirurgie, kan een tijdelijk verlies van glycemische controle optreden. Op dergelijke momenten kan het nodig zijn om Glucophage of Glucophage XR te onthouden en tijdelijk insuline toe te dienen. Glucofaag of Glucofaag XR kan worden hersteld nadat de acute episode is opgelost.
De effectiviteit van orale antidiabetica bij het verlagen van de bloedglucose tot een doelniveau neemt bij veel patiënten in de loop van de tijd af. Dit fenomeen, dat mogelijk te wijten is aan progressie van de onderliggende ziekte of aan verminderde respons op het medicijn, is bekend als secundair falen, om het te onderscheiden van primair falen waarbij het medicijn niet effectief is tijdens de initiële therapie. Als secundair falen optreedt met Glucophage of Glucophage XR of sulfonylurea monotherapie, kan gecombineerde therapie met Glucophage of Glucophage XR en sulfonylurea resulteren in een reactie. Indien secundair falen optreedt met gecombineerde Glucophage / sulfonylureumtherapie of Glucophage XR / sulfonylureumtherapie, kan het nodig zijn om therapeutische alternatieven te overwegen, waaronder initiatie van insuline therapie.
Informatie voor patiënten
Patiënten moeten worden geïnformeerd over de mogelijke risico's en voordelen van Glucophage of Glucophage XR en van alternatieve therapiemethoden. Ze moeten ook worden geïnformeerd over het belang van het volgen van dieetinstructies, van een regelmatige oefening en regelmatig testen van bloedglucose, geglycosyleerd hemoglobine, nierfunctie en hematologisch parameters.
De risico's van lactaatacidose, de symptomen en aandoeningen die vatbaar zijn voor de ontwikkeling ervan, zoals vermeld in de WAARSCHUWINGEN en VOORZORGSMAATREGELEN secties, moeten worden uitgelegd aan patiënten. Patiënten moeten worden geadviseerd om onmiddellijk te stoppen met Glucophage of Glucophage XR en hun gezondheid onmiddellijk te melden behandelaar als onverklaarbare hyperventilatie, myalgie, malaise, ongewone slaperigheid of andere niet-specifieke symptomen optreden. Als een patiënt eenmaal is gestabiliseerd op een dosisniveau van Glucophage of Glucophage XR, is het onwaarschijnlijk dat gastro-intestinale symptomen, die vaak optreden tijdens het starten van metformine-therapie, geneesmiddelgerelateerd zijn. Later optreden van gastro-intestinale symptomen kan te wijten zijn aan lactaatacidose of een andere ernstige ziekte.
Patiënten moeten worden geadviseerd tegen overmatige alcoholinname, acuut of chronisch, tijdens het gebruik van Glucophage of Glucophage XR.
Glucofaag of Glucofaag XR alleen veroorzaakt meestal geen hypoglykemie, hoewel het kan optreden wanneer Glucofaag of Glucofaag XR wordt gebruikt in combinatie met orale sulfonylureumderivaten en insuline. Bij het starten van combinatietherapie, de risico's van hypoglykemie, de symptomen en behandeling ervan, en aandoeningen die vatbaar zijn voor de ontwikkeling ervan, moeten aan patiënten en de verantwoordelijke familie worden uitgelegd leden.
Patiënten moeten worden geïnformeerd dat Glucophage XR heel moet worden doorgeslikt en niet geplet of gekauwd, en dat de inactieve ingrediënten kunnen soms worden verwijderd in de ontlasting als een zachte massa die op het origineel kan lijken tablet.
Laboratorium testen
De respons op alle diabetische therapieën moet worden gemonitord door periodieke metingen van nuchter bloed glucose en geglycosyleerde hemoglobinewaarden, met als doel deze waarden naar normaal te verlagen range. Tijdens de initiële dosistitratie kan nuchtere glucose worden gebruikt om de therapeutische respons te bepalen. Daarna moeten zowel glucose als geglycosyleerd hemoglobine worden gecontroleerd. Metingen van geglycosyleerd hemoglobine kunnen vooral nuttig zijn voor het evalueren van langetermijncontrole (zie ook DOSERING EN ADMINISTRATIE).
Eerste en periodieke monitoring van hematologische parameters (bijv. Hemoglobine / hematocriet en rood bloed celindices) en nierfunctie (serumcreatinine) moeten worden uitgevoerd, ten minste op jaarbasis. Hoewel megaloblastikemie zelden wordt gezien bij behandeling met Glucofagen, moet vitamine B12-tekort worden uitgesloten als dit wordt vermoed.
Geneesmiddelinteracties (klinische evaluatie van geneesmiddeleninteracties met glucofagen)
Glyburide — In een onderzoek naar interacties met één dosis bij diabetes type 2, gelijktijdige toediening van metformine en glyburide resulteerden niet in veranderingen in de farmacokinetiek van metformine of farmacodynamiek. Dalingen van de AUC en Cmax van glyburide werden waargenomen, maar waren zeer variabel. Het enkele dosis karakter van deze studie en het gebrek aan correlatie tussen glyburide bloedspiegels en farmacodynamische effecten, maakt de klinische betekenis van deze interactie onzeker (zie DOSERING EN ADMINISTRATIE: Gelijktijdige glucofaag of glucofaag XR en orale sulfonylureumtherapie bij volwassen patiënten).
Furosemide — Een geneesmiddelinteractie-onderzoek met eenmalige dosis metformine-furosemide bij gezonde proefpersonen toonde aan dat de farmacokinetische parameters van beide verbindingen werden beïnvloed door gelijktijdige toediening. Furosemide verhoogde de metformine-plasma en de bloed-Cmax met 22% en de bloed-AUC met 15%, zonder enige significante verandering in de nierklaring van metformine. Bij toediening met metformine waren de Cmax en AUC van furosemide respectievelijk 31% en 12% kleiner dan wanneer alleen toegediend, en de terminale halfwaardetijd was met 32% verminderd, zonder enige significante verandering in de nierfunctie van furosemide klaring. Er is geen informatie beschikbaar over de interactie van metformine en furosemide bij chronische toediening.
Nifedipine — Een geneesmiddelinteractieonderzoek met eenmalige dosis metformine-nifedipine bij normale gezonde vrijwilligers toonde aan dat gelijktijdige toediening van nifedipine verhoogde de Cmax en AUC van plasma metformine met respectievelijk 20% en 9%, en verhoogde de hoeveelheid uitgescheiden in de urine. Tmax en halfwaardetijd werden niet beïnvloed. Nifedipine lijkt de absorptie van metformine te verbeteren. Metformine had minimale effecten op nifedipine.
Kationische geneesmiddelen - Kationische geneesmiddelen (bijv. Amiloride, digoxine, morfine, procaïnamide, kinidine, kinine, ranitidine, triamtereen, trimethoprim of vancomycine) die worden geëlimineerd door renale tubulaire secretie hebben theoretisch het potentieel voor interactie met metformine door te concurreren voor gemeenschappelijk niertubulair transport systemen. Een dergelijke interactie tussen metformine en oraal cimetidine is waargenomen bij normale gezonde vrijwilligers in metformine-cimetidine met enkelvoudige en meervoudige doses geneesmiddelinteractiestudies, met een toename van 60% in piekmetformine-plasma en volbloedconcentraties en een 40% toename in plasma en volbloed-metformine AUC. Er was geen verandering in de eliminatiehalfwaardetijd in het onderzoek met enkele dosis. Metformine had geen effect op de farmacokinetiek van cimetidine. Hoewel dergelijke interacties theoretisch blijven (behalve cimetidine), zorgvuldige monitoring van de patiënt en dosisaanpassing van Glucophage of Glucophage XR en / of het interfererende medicijn wordt aanbevolen bij patiënten die kationische medicijnen gebruiken die worden uitgescheiden via de proximale renale tubulaire secretie systeem.
Overige - Bepaalde geneesmiddelen hebben de neiging hyperglykemie te veroorzaken en kunnen leiden tot verlies van glykemische controle. Deze geneesmiddelen omvatten de thiaziden en andere diuretica, corticosteroïden, fenothiazinen, schildklierproducten, oestrogenen, orale anticonceptiva, fenytoïne, nicotinezuur, sympathomimetica, calciumantagonisten, en isoniazide. Wanneer dergelijke geneesmiddelen worden toegediend aan een patiënt die Glucophage of Glucophage XR krijgt, moet de patiënt nauwlettend worden geobserveerd op verlies van bloedglucosecontrole. Wanneer dergelijke geneesmiddelen worden teruggetrokken uit een patiënt die Glucophage of Glucophage XR krijgt, moet de patiënt nauwlettend worden geobserveerd op hypoglykemie.
Bij gezonde vrijwilligers werd de farmacokinetiek van metformine en propranolol en metformine en ibuprofen niet beïnvloed bij gelijktijdige toediening in interactiestudies met enkelvoudige doses.
Metformine is verwaarloosbaar gebonden aan plasmaproteïnen en heeft daarom minder kans om te interageren met sterk eiwitgebonden medicijnen zoals salicylaten, sulfonamiden, chlooramfenicol en probenecide, in vergelijking met de sulfonylureumderivaten, die uitgebreid zijn gebonden aan serum eiwitten.
Carcinogenese, mutagenese, aantasting van de vruchtbaarheid
Lange termijn carcinogeniteitsstudies zijn uitgevoerd bij ratten (doseringsduur van 104 weken) en muizen (doseringsduur van 91 weken) bij doses tot en met 900 mg / kg / dag en 1500 mg / kg / dag, respectievelijk. Deze doses zijn beide ongeveer 4 keer de maximale aanbevolen dagelijkse menselijke dosis van 2000 mg op basis van vergelijkingen van het lichaamsoppervlak. Bij mannelijke of vrouwelijke muizen zijn geen aanwijzingen gevonden voor carcinogeniteit met metformine. Evenzo werd er geen mannelijk potentieel waargenomen met metformine bij mannelijke ratten. Er was echter een verhoogde incidentie van goedaardige stromale uteriene poliepen bij vrouwelijke ratten die werden behandeld met 900 mg / kg / dag.
Er waren geen aanwijzingen voor een mutageen potentieel van metformine in de volgende in-vitrotests: Ames-test (S. typhimurium), genmutatietest (lymfoomcellen van muizen) of chromosomale aberratietest (menselijke lymfocyten). De resultaten in de in vivo micronucleustest bij muizen waren ook negatief.
De vruchtbaarheid van mannelijke of vrouwelijke ratten werd niet beïnvloed door metformine bij toediening in doses van maximaal 600 mg / kg / dag, wat ongeveer driemaal de maximale aanbevolen dagelijkse dosis voor mensen is, gebaseerd op het lichaamsoppervlak vergelijkingen.
Zwangerschap
Teratogene effecten: Zwangerschap Categorie B
Recente informatie suggereert sterk dat abnormale bloedglucosewaarden tijdens de zwangerschap geassocieerd zijn met een hogere incidentie van aangeboren afwijkingen. De meeste experts bevelen aan dat insuline tijdens de zwangerschap wordt gebruikt om de bloedsuikerspiegel zo dicht mogelijk bij normaal te houden. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de menselijke respons, mogen Glucophage en Glucophage XR niet tijdens de zwangerschap worden gebruikt, tenzij strikt noodzakelijk.
Er zijn geen toereikende en goed gecontroleerde studies bij zwangere vrouwen met Glucophage of Glucophage XR. Metformine was niet teratogeen bij ratten en konijnen in doses tot 600 mg / kg / dag. Dit vertegenwoordigt een blootstelling van ongeveer 2 en 6 keer de maximale aanbevolen dagelijkse dosis voor de mens van 2000 mg op basis van vergelijkingen van het lichaamsoppervlak voor respectievelijk ratten en konijnen. Bepaling van foetale concentraties toonde een gedeeltelijke placentabarrière voor metformine.
Moeders die borstvoeding geven
Studies bij zogende ratten tonen aan dat metformine wordt uitgescheiden in melk en niveaus bereikt die vergelijkbaar zijn met die in plasma. Soortgelijke studies zijn niet uitgevoerd bij moeders die borstvoeding geven. Omdat het potentieel voor hypoglykemie bij zuigelingen kan bestaan, moet worden besloten of dit wel het geval is stop de borstvoeding of stop met het medicijn, rekening houdend met het belang van het medicijn voor de moeder. Als Glucophage of Glucophage XR wordt gestaakt en als het dieet alleen onvoldoende is om de bloedglucose onder controle te houden, moet een insulinetherapie worden overwogen.
Gebruik bij kinderen
De veiligheid en effectiviteit van Glucophage voor de behandeling van diabetes type 2 zijn vastgesteld in pediatrische patiënten in de leeftijd van 10 tot 16 jaar (er zijn geen onderzoeken uitgevoerd bij pediatrische patiënten jonger dan 10 jaar jaar). Het gebruik van glucofagen in deze leeftijdsgroep wordt ondersteund door gegevens uit toereikende en goed gecontroleerde onderzoeken van glucofagen bij volwassenen met aanvullende gegevens van een gecontroleerde klinische studie bij pediatrische patiënten in de leeftijd van 10 tot 16 jaar met diabetes type 2, die een vergelijkbare respons vertoonde in glycemische controle als die waargenomen bij volwassenen. (Zien KLINISCHE FARMACOLOGIE: Pediatrische klinische studies.) In deze studie waren de bijwerkingen vergelijkbaar met die beschreven bij volwassenen. (Zien BIJWERKINGEN: Pediatrische patiënten.) Een maximale dagelijkse dosis van 2000 mg wordt aanbevolen. (Zien DOSERING EN ADMINISTRATIE: Aanbevolen doseerschema: kindergeneeskunde.)
Veiligheid en effectiviteit van Glucophage XR bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Gecontroleerde klinische studies van Glucophage en Glucophage XR omvatten onvoldoende aantallen oudere patiënten om te bepalen of zij reageren anders dan jongere patiënten, hoewel andere gerapporteerde klinische ervaring geen verschillen in respons tussen ouderen en jongere heeft geïdentificeerd patiënten. Van metformine is bekend dat het substantieel door de nier wordt uitgescheiden en omdat het risico op ernstige bijwerkingen op het geneesmiddel groter is bij patiënten met een verminderde nierfunctie dienen Glucophage en Glucophage XR alleen te worden gebruikt bij patiënten met een normale nierfunctie (zie CONTRA, WAARSCHUWINGENen KLINISCHE FARMACOLOGIE: Farmacokinetiek). Omdat veroudering gepaard gaat met een verminderde nierfunctie, moet Glucophage of Glucophage XR met voorzichtigheid worden gebruikt naarmate de leeftijd toeneemt. Voorzichtigheid is geboden bij de dosiskeuze en moet gebaseerd zijn op zorgvuldige en regelmatige controle van de nierfunctie. Over het algemeen mogen oudere patiënten niet worden getitreerd tot de maximale dosis Glucophage of Glucophage XR (zie ook WAARSCHUWINGEN en DOSERING EN ADMINISTRATIE).
top
Bijwerkingen
In een Amerikaans dubbelblind klinisch onderzoek naar glucofaag bij patiënten met diabetes type 2 ontvingen in totaal 141 patiënten Glucofaag-therapie (tot 2550 mg per dag) en 145 patiënten kregen placebo. Bijwerkingen gemeld bij meer dan 5% van de Glucophage-patiënten, en die vaker voorkwamen bij met Glucophage dan bij met placebo behandelde patiënten, staan vermeld in Tabel 11.
Tabel 11: Meest voorkomende bijwerkingen (> 5,0 procent) in een placebogecontroleerde klinische studie van glucofaagmonotherapie *
| Tegengestelde reactie | Glucophage monotherapie (N = 141) |
Placebo (N = 145) |
|---|---|---|
| % van de patiënten | ||
| * Reacties die vaker bij Glucophage voorkwamen dan bij met placebo behandelde patiënten. | ||
| Diarree | 53.2 | 11.7 |
| Misselijkheid / braken | 25.5 | 8.3 |
| Winderigheid | 12.1 | 5.5 |
| asthenie | 9.2 | 5.5 |
| Indigestie | 7.1 | 4.1 |
| Buikpijn | 6.4 | 4.8 |
| Hoofdpijn | 5.7 | 4.8 |
Diarree leidde tot stopzetting van onderzoeksmedicatie bij 6% van de patiënten die werden behandeld met glucofaag. Bovendien werden de volgende bijwerkingen gemeld bij â ‰ ¥ 1,0% tot â ‰ ¤5,0% van Glucophage-patiënten en werden vaker gemeld met Glucophage dan met placebo: abnormale ontlasting, hypoglykemie, myalgie, licht in het hoofd, kortademigheid, nagelaandoening, huiduitslag, zweten verhoogd, smaakstoornis, ongemak op de borst, koude rillingen, griepsyndroom, blozen, hartkloppingen.
In wereldwijde klinische onderzoeken zijn meer dan 900 patiënten met diabetes type 2 behandeld met Glucophage XR in placebo- en actief gecontroleerde onderzoeken. In placebogecontroleerde onderzoeken kregen 781 patiënten Glucophage XR toegediend en kregen 195 patiënten placebo. Bijwerkingen gemeld bij meer dan 5% van de Glucophage XR-patiënten, en die vaker voorkwamen bij Glucophage XR- dan met placebo behandelde patiënten, zijn vermeld in tabel 12.
Tabel 12: Meest voorkomende bijwerkingen (> 5,0 procent) in placebogecontroleerde onderzoeken naar Glucofaag XR *
| Tegengestelde reactie | Glucofaag XR (N = 781) |
Placebo (N = 195) |
|---|---|---|
| % van de patiënten | ||
| * Reacties die vaker voorkwamen bij Glucophage XR- dan met placebo behandelde patiënten. | ||
| Diarree | 9.6 | 2.6 |
| Misselijkheid / braken | 6.5 | 1.5 |
Diarree leidde tot stopzetting van onderzoeksmedicatie bij 0,6% van de patiënten behandeld met Glucophage XR. Bovendien werden de volgende bijwerkingen gemeld bij â ‰ ¥ 1,0% tot â ‰ ¤5,0% van Glucophage XR-patiënten en werden vaker gemeld met Glucophage XR dan placebo: buikpijn, constipatie, opgezette buik, dyspepsie / maagzuur, winderigheid, duizeligheid, hoofdpijn, bovenste luchtweginfectie, smaak verstoring.
Pediatrische patiënten
In klinische onderzoeken met glucofaag bij pediatrische patiënten met diabetes type 2 was het bijwerkingenprofiel vergelijkbaar met dat waargenomen bij volwassenen.
top
Overdose
Er is een overdosis metforminehydrochloride opgetreden, inclusief inname van hoeveelheden van meer dan 50 gram. Hypoglykemie werd in ongeveer 10% van de gevallen gemeld, maar er is geen oorzakelijk verband met metforminehydrochloride vastgesteld. Lactaatacidose is gemeld bij ongeveer 32% van de gevallen van overdosering met metformine (zie WAARSCHUWINGEN). Metformine is dialyseerbaar met een klaring tot 170 ml / min onder goede hemodynamische omstandigheden. Daarom kan hemodialyse nuttig zijn voor het verwijderen van geaccumuleerd geneesmiddel bij patiënten bij wie een overdosis metformine wordt vermoed.
top
Dosering en administratie
Er is geen vast doseringsschema voor de behandeling van hyperglykemie bij patiënten met diabetes type 2 met Glucophage of Glucophage XR of enig ander farmacologisch middel. De dosering van Glucophage of Glucophage XR moet worden geïndividualiseerd op basis van zowel effectiviteit als tolerantie, waarbij de maximale aanbevolen dagelijkse doses niet worden overschreden. De maximale aanbevolen dagelijkse dosis glucofaag is 2550 mg bij volwassenen en 2000 mg bij pediatrische patiënten (10-16 jaar oud); de maximale aanbevolen dagelijkse dosis Glucophage XR bij volwassenen is 2000 mg.
Glucofaag moet in verdeelde doses bij de maaltijd worden gegeven, terwijl Glucophage XR in het algemeen eenmaal daags bij de avondmaaltijd moet worden gegeven. Glucophage of Glucophage XR moet worden gestart met een lage dosis, met geleidelijke dosisverhoging, beide om gastro-intestinale bijwerkingen en om identificatie van de minimumdosis mogelijk te maken die nodig is voor adequate glykemische controle van de patiënt.
Tijdens de start van de behandeling en dosistitratie (zie aanbevolen doseringsschema hieronder), moet nuchtere plasmaglucose zijn gebruikt om de therapeutische respons op Glucophage of Glucophage XR te bepalen en de minimale effectieve dosis voor de geduldig. Daarna moet geglycosyleerd hemoglobine worden gemeten met tussenpozen van ongeveer 3 maanden. Het therapeutische doel moet zijn om zowel nuchtere plasmaglucose als geglycosyleerde hemoglobinewaarden met normaal of bijna normaal te verlagen gebruik van de laagste effectieve dosis Glucophage of Glucophage XR, hetzij bij gebruik als monotherapie of in combinatie met sulfonylureum of insuline.
Monitoring van bloedglucose en geglycosyleerd hemoglobine zal ook detectie van primair falen mogelijk maken, d.w.z. onvoldoende verlaging van bloedglucose aan de maximale aanbevolen dosis medicatie en secundair falen, d.w.z. verlies van een adequate bloedglucoseverlagende reactie na een initiële periode van effectiviteit.
Kortdurende toediening van Glucophage of Glucophage XR kan voldoende zijn tijdens perioden van voorbijgaand controleverlies bij patiënten die gewoonlijk goed onder controle zijn met alleen het dieet.
Glucophage XR-tabletten moeten heel worden doorgeslikt en mogen nooit worden fijngemaakt of gekauwd. Af en toe worden de inactieve ingrediënten van Glucophage XR geëlimineerd in de ontlasting als een zachte, gehydrateerde massa.
Aanbevolen doseringsschema
volwassenen
Over het algemeen worden geen klinisch significante reacties gezien bij doses lager dan 1500 mg per dag. Een lagere aanbevolen startdosis en een geleidelijk verhoogde dosis wordt echter geadviseerd om gastro-intestinale symptomen te minimaliseren.
De gebruikelijke startdosis Glucophage (metforminehydrochloride) tabletten is 500 mg tweemaal daags of 850 mg eenmaal daags, toegediend bij de maaltijd. De dosis moet worden verhoogd in stappen van 500 mg per week of 850 mg om de 2 weken, tot een totaal van 2000 mg per dag, verdeeld over de doses. Patiënten kunnen ook worden getitreerd van 500 mg tweemaal daags tot 850 mg tweemaal daags na 2 weken. Voor die patiënten die extra glykemische controle nodig hebben, kan Glucophage worden gegeven tot een maximale dagelijkse dosis van 2550 mg per dag. Doses boven 2000 mg kunnen beter worden verdragen gegeven 3 keer per dag bij de maaltijd.
De gebruikelijke startdosis Glucophage XR (metforminehydrochloride) tabletten met verlengde afgifte is 500 mg eenmaal daags bij het avondmaal. Doseringsverhogingen moeten worden uitgevoerd in stappen van 500 mg per week, tot een maximum van 2000 mg eenmaal daags bij het avondmaal. Als glykemische controle niet wordt bereikt op Glucophage XR 2000 mg eenmaal daags, moet een proef met Glucophage XR 1000 mg tweemaal daags worden overwogen. Als hogere doses metformine vereist zijn, moet Glucophage worden gebruikt bij totale dagelijkse doses tot 2550 mg toegediend in verdeelde dagelijkse doses, zoals hierboven beschreven. (Zien KLINISCHE FARMACOLOGIE: Klinische studies.)
In een gerandomiseerde studie werden patiënten die momenteel worden behandeld met Glucophage overgeschakeld naar Glucophage XR. Resultaten van deze studie suggereren dat patiënten die een behandeling met Glucophage krijgen veilig kunnen worden overgeschakeld op Glucophage XR eenmaal daags met dezelfde totale dagelijkse dosis, tot 2000 mg eenmaal daags. Na een overschakeling van glucofaag naar glucofaag XR, moet de glykemische controle nauwlettend worden gevolgd en de dosis dienovereenkomstig worden aangepast (zie KLINISCHE FARMACOLOGIE: Klinische studies).
Kindergeneeskunde
De gebruikelijke startdosis Glucophage is tweemaal daags 500 mg, gegeven bij de maaltijd. De dosis moet worden verhoogd in stappen van 500 mg per week tot een maximum van 2000 mg per dag, verdeeld over de doses. Veiligheid en effectiviteit van Glucophage XR bij pediatrische patiënten zijn niet vastgesteld.
Overzetten van andere antidiabetische therapie
Bij het overbrengen van patiënten van andere standaard orale hypoglycemische middelen dan chloorpropamide naar Glucophage of Glucophage XR, is in het algemeen geen overgangsperiode nodig. Bij het overbrengen van patiënten van chloorpropamide moet tijdens de eerste 2 weken voorzichtigheid worden betracht vanwege de langdurig behoud van chloorpropamide in het lichaam, wat leidt tot overlappende effecten op het geneesmiddel en mogelijke hypoglykemie.
Gelijktijdige glucofaag of glucofaag XR en orale sulfonylureumtherapie bij volwassen patiënten
Als patiënten niet hebben gereageerd op 4 weken van de maximale dosis Glucophage of Glucophage XR als monotherapie, moet worden overwogen om geleidelijk een orale sulfonylureum terwijl Glucophage of Glucophage XR wordt voortgezet bij de maximale dosis, zelfs als voorafgaand primair of secundair falen van een sulfonylureum heeft heeft plaatsgevonden. Klinische en farmacokinetische interactiegegevens tussen geneesmiddelen zijn momenteel alleen beschikbaar voor metformine plus glyburide (glibenclamide).
Met gelijktijdige Glucophage of Glucophage XR en sulfonylureumtherapie kan de gewenste controle van bloedglucose worden verkregen door de dosis van elk geneesmiddel aan te passen. In een klinisch onderzoek met patiënten met type 2 diabetes en eerder falen op glyburide, begonnen patiënten met Glucophage 500 mg en werd glyburide 20 mg getitreerd tot 1000/20 mg, 1500/20 mg, 2000/20 mg of 2500/20 mg respectievelijk Glucophage en glyburide om het doel van glycemische controle te bereiken, zoals gemeten door FPG, HbA1c en plasmaglucoserespons (zien KLINISCHE FARMACOLOGIE: Klinische studies). Er moeten echter pogingen worden gedaan om de minimale effectieve dosis van elk medicijn te identificeren om dit doel te bereiken. Bij gelijktijdige Glucofaag of Glucofaag XR en sulfonylureumtherapie blijft het risico op hypoglykemie geassocieerd met sulfonylureumtherapie bestaan en kan het worden verhoogd. Passende voorzorgsmaatregelen moeten worden genomen. (Zie bijsluiter van de respectieve sulfonylureum.)
Als patiënten niet naar tevredenheid hebben gereageerd op 1 tot 3 maanden van gelijktijdige therapie met de maximale dosis Glucophage of Glucophage XR en de maximale dosis van een orale sulfonylureum, overweeg therapeutische alternatieven, waaronder overschakelen op insuline met of zonder Glucophage of Glucophage XR.
Gelijktijdige glucofaag of glucofaag XR en insulinetherapie bij volwassen patiënten
De huidige insulinedosis moet worden voortgezet bij aanvang van de behandeling met Glucophage of Glucophage XR. Glucofaag of Glucofaag XR-therapie moet worden gestart met 500 mg eenmaal daags bij patiënten die met insuline worden behandeld. Voor patiënten die niet adequaat reageren, moet de dosis Glucophage of Glucophage XR worden verhoogd met 500 mg na ongeveer 1 week en daarna elke week met 500 mg totdat voldoende glykemische controle is bereikt. De maximale aanbevolen dagelijkse dosis is 2500 mg voor Glucophage en 2000 mg voor Glucophage XR. Het wordt aanbevolen om de insulinedosis met 10% tot 25% te verlagen bij het vasten van plasmaglucose concentraties dalen tot minder dan 120 mg / dl bij patiënten die gelijktijdig insuline en glucofagen krijgen of Glucofaag XR. Verdere aanpassing moet worden geïndividualiseerd op basis van glucoseverlagende respons.
Specifieke patiëntenpopulaties
Glucofaag of Glucofaag XR worden niet aanbevolen voor gebruik tijdens de zwangerschap. Glucofaag wordt niet aanbevolen bij patiënten jonger dan 10 jaar. Glucofaag XR wordt niet aanbevolen bij pediatrische patiënten (jonger dan 17 jaar).
De initiële en onderhoudsdosering van Glucophage of Glucophage XR moet conservatief zijn bij patiënten met gevorderde leeftijd, vanwege het potentieel voor verminderde nierfunctie in deze populatie. Elke dosisaanpassing moet gebaseerd zijn op een zorgvuldige beoordeling van de nierfunctie. Over het algemeen mogen oudere, verzwakte en ondervoede patiënten niet worden getitreerd tot de maximale dosis Glucophage of Glucophage XR.
Controle van de nierfunctie is noodzakelijk om te helpen bij het voorkomen van melkzuuracidose, met name bij ouderen. (Zien WAARSCHUWINGEN.)
top
Hoe geleverd
Glucophage® (metforminehydrochloride) tabletten
| 500 mg | Flessen van 100 | NDC 0087-6060-05 |
| 500 mg | Flessen van 500 | NDC 0087-6060-10 |
| 850 mg | Flessen van 100 | NDC 0087-6070-05 |
| 1000 mg | Flessen van 100 | NDC 0087-6071-11 |
Glucofaag 500 mg tabletten zijn ronde, witte tot gebroken witte, filmomhulde tabletten met het opschrift "BMS" 6060 "rond de omtrek van de tablet aan de ene kant en" 500 "ingeslagen over de voorkant van de andere kant.
Glucofaag 850 mg tabletten zijn ronde, witte tot gebroken witte, filmomhulde tabletten met het opschrift "BMS" 6070 "aan de ene kant van de tabletrand en" 850 "aan de andere kant ingeslagen kant.
Glucofaag 1000 mg tabletten zijn witte, ovale, biconvexe, filmomhulde tabletten met aan één zijde "BMS 6071" en aan de andere zijde de inscriptie "1000" en aan beide zijden een bisectielijn.
Glucophage® XR (metforminehydrochloride) tabletten met verlengde afgifte
| 500 mg | Flessen van 100 | NDC 0087-6063-13 |
| 750 mg | Flessen van 100 | NDC 0087-6064-13 |
Glucofaag XR 500 mg tabletten zijn witte tot gebroken witte, capsulevormige, biconvexe tabletten, met aan één zijde de inscriptie "BMS 6063" en aan de andere zijde de inscriptie "500".
Glucofaag XR 750 mg tabletten zijn capsulevormige, biconvexe tabletten, met aan de ene zijde "BMS 6064" en aan de andere zijde de inscriptie "750". De tabletten zijn lichtrood en kunnen er gevlekt uitzien.
opslagruimte
Bewaren bij 20 ° -25 ° C (68 ° -77 ° F); excursies toegestaan tot 15 ° -30 ° C (59 ° -86 ° F). [Zie USP Gecontroleerde kamertemperatuur.]
Verstrek in lichtbestendige containers.
Glucophage® is een gedeponeerd handelsmerk van Merck Santà © S.A.S., een partner van Merck KGaA uit Darmstadt, Duitsland. In licentie gegeven aan Bristol-Myers Squibb Company.
Gedistribueerd door:
Bristol-Myers Squibb Company
Princeton, NJ 08543 VS.
Laatste update: 01/2009
Glucohage, metforminehydrochloride, patiëntinformatie (In gewoon Engels)
Gedetailleerde informatie over tekenen, symptomen, oorzaken, behandelingen van diabetes
De informatie in deze monografie is niet bedoeld om alle mogelijke toepassingen, aanwijzingen, voorzorgsmaatregelen, interacties tussen geneesmiddelen of bijwerkingen te dekken. Deze informatie is algemeen en is niet bedoeld als specifiek medisch advies. Neem contact op met uw arts, apotheker of verpleegkundige als u vragen heeft over de medicijnen die u gebruikt of meer informatie wilt.
terug naar: Blader door alle medicijnen voor diabetes


