Exubera voor de behandeling van diabetes
Merknaam: Exubera
Generieke naam: humane insuline
Doseringsvorm: inhalatiepoeder
Inhoud:
Beschrijving
Klinische Farmacologie
Klinische studies
Aanwijzingen en gebruik
Contra
waarschuwingen
Voorzorgsmaatregelen
Geneesmiddelinteracties
Bijwerkingen
overdosering
Dosering en administratie
Hoe geleverd
Exubera, insuline humaan [rDNA-oorsprong] Patiëntinformatie (In gewoon Engels)
Beschrijving
Exubera® bestaat uit blaren met humaan insuline-inhalatiepoeder, die worden toegediend met behulp van de Exubera® Inhaler. Exubera-blaren bevatten humane insuline geproduceerd door recombinant-DNA-technologie met behulp van een niet-pathogene laboratoriumstam van Escherichia coli (K12). Chemisch gezien heeft humane insuline de empirische formule C257H383N65O77S6 en een molecuulgewicht van 5808. Menselijke insuline heeft de volgende primaire aminozuursequentie:
Exubera (humane insuline [oorsprong van rDNA]) Inhalatiepoeder is een wit tot gebroken wit poeder in een blister met eenheidsdosis (vulmassa, zie tabel 1). Elke blisterverpakking met Exubera bevat een dosis van 1 mg of 3 mg insuline (zie tabel 1) in een homogene poederformulering die natriumcitraat (dihydraat), mannitol, glycine en natrium bevat hydroxide. Nadat een Exubera-blister in de inhalator is ingebracht, pompt de patiënt de hendel van de inhalator en drukt vervolgens op een knop, waardoor de blister wordt doorboord. Het insuline-inhalatiepoeder wordt vervolgens in de kamer gedispergeerd, waardoor de patiënt het aerosolpoeder kan inhaleren.
Onder gestandaardiseerde in-vitrotestomstandigheden levert Exubera een specifieke uitgestoten dosis insuline uit het mondstuk van de inhalator (zie tabel 1). Een fractie van de totale deeltjesmassa wordt uitgestoten als fijne deeltjes die de diepe long kunnen bereiken. Tot 45% van de inhoud van 1 mg blister en tot 25% van de inhoud van 3 mg blister kan in de blister worden bewaard.
Tabel 1: Dosisnomenclatuur en informatie
| Vul massa (mg poeder) |
Nominale dosis (mg insuline) |
Uitgezonden dosis*,†(mg insuline) |
Fijne deeltjesdosisc,†(mg insuline) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
De werkelijke hoeveelheid insuline die aan de long wordt toegediend, is afhankelijk van individuele patiëntfactoren, zoals het inademingsprofiel. In vitro worden geëmitteerde aerosolmetrieken niet beïnvloed bij stroomsnelheden boven 10 L / min.
top
Klinische Farmacologie
Werkingsmechanisme
De primaire activiteit van insuline is regulering van het glucosemetabolisme. Insuline verlaagt de bloedglucoseconcentraties door de opname van perifere glucose door skeletspieren en vet te stimuleren en door de productie van hepatische glucose te remmen. Insuline remt lipolyse in de adipocyten, remt proteolyse en verbetert de eiwitsynthese.
farmacokinetiek
Absorptie
Exubera levert insuline door orale inhalatie. De insuline wordt even snel opgenomen als subcutaan toegediende snelwerkende insuline-analogen en sneller dan subcutaan toegediend humane insuline bij gezonde personen en bij patiënten met type 1 of type 2 diabetes (zie Figuur 1).
Figuur 1: Gemiddelde veranderingen in vrije insulineserumconcentraties (µU / ml) bij patiënten met diabetes type 2 na Toediening van enkele doses geïnhaleerde insuline van Exubera (6 mg) en subcutane normale humane insuline (18U)
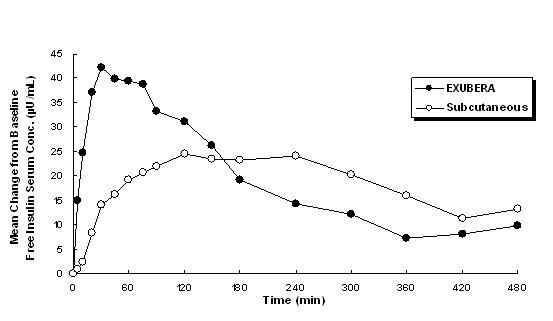
In klinische onderzoeken bij patiënten met type 1 en type 2 diabetes bereikte seruminsuline na inhalatie van Exubera sneller een piekconcentratie dan na subcutane injectie van normale humane insuline, 49 minuten (bereik 30 tot 90 minuten) vergeleken met 105 minuten (bereik 60 tot 240 minuten), respectievelijk.
In klinische onderzoeken daalde de absorptie van subcutane normale humane insuline met een toenemende body mass index (BMI) van de patiënt. De absorptie van insuline na inhalatie van Exubera was echter onafhankelijk van BMI.
In een onderzoek bij gezonde personen, systemische blootstelling aan insuline (AUC en Cmax) na toediening van Exubera nam toe met de dosis over een bereik van 1 tot 6 mg bij toediening als combinaties van 1 en 3 mg blaren.
In een onderzoek waarbij de doseringsvorm van drie blisters van 1 mg werd vergeleken met één blister van 3 mg, Cmax en AUC na toediening van drie blisters van 1 mg waren respectievelijk ongeveer 30% en 40% groter dan die na toediening van één blister van 3 mg (zie DOSERING EN ADMINISTRATIE).
Distributie en eliminatie
Omdat recombinante humane insuline identiek is aan endogene insuline, wordt verwacht dat de systemische verdeling en eliminatie hetzelfde zijn. Dit is echter niet bevestigd voor Exubera.
farmacodynamiek
Exubera heeft, net als subcutaan toegediende snelwerkende insuline-analogen, een sneller begin van glucoseverlagende activiteit dan subcutaan toegediende reguliere humane insuline. Bij gezonde vrijwilligers was de duur van glucoseverlagende activiteit voor Exubera vergelijkbaar met subcutaan gewone humane insuline toegediend en langer dan subcutaan toegediend snelwerkende insuline-analogen (zie Figuur 2).
Figuur 2. Gemiddelde glucose-infusiesnelheid (GIR) genormaliseerd op GIRmax voor elk onderwerp Behandeling versus tijd bij gezonde vrijwilligers
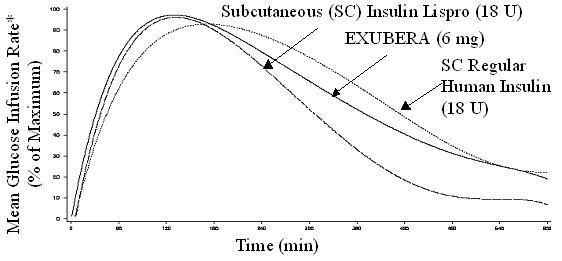
* Bepaald als hoeveelheid toegediende glucose om constante plasmaglucoseconcentraties te handhaven, genormaliseerd op maximale waarden (percentage van maximale waarden); indicatief voor insuline-activiteit.
Wanneer Exubera wordt ingeademd, treedt het begin van glucoseverlagende activiteit bij gezonde vrijwilligers binnen 10-20 minuten op. Het maximale effect op glucoseverlaging wordt ongeveer 2 uur na inhalatie uitgeoefend. De duur van glucoseverlagende activiteit is ongeveer 6 uur.
Bij patiënten met type 1 of type 2 diabetes heeft Exubera een groter glucoseverlagend effect binnen de eerste twee uur na toediening in vergelijking met subcutaan toegediende reguliere humane insuline.
De intra-individuele variabiliteit van glucoseverlagende activiteit van Exubera is in het algemeen vergelijkbaar met die van subcutaan toegediende reguliere humane insuline bij patiënten met diabetes type 1 en 2.
Speciale populaties
Pediatrische patiënten
Bij kinderen (6-11 jaar) en adolescenten (12-17 jaar) met diabetes type 1 was de tijd tot piekinsuline-concentratie voor Exubera sneller bereikt dan voor subcutane normale humane insuline, wat consistent is met waarnemingen bij volwassen patiënten met type 1 diabetes.
Geriatrische patiënten
Er zijn geen duidelijke verschillen in de farmacokinetische eigenschappen van Exubera bij het vergelijken van patiënten ouder dan 65 jaar met jongere volwassen patiënten.
Geslacht
Bij personen met en zonder diabetes werden geen duidelijke verschillen in de farmacokinetische eigenschappen van Exubera waargenomen tussen mannen en vrouwen.
Ras
Een studie werd uitgevoerd bij 25 gezonde blanke en Japanse niet-diabetische proefpersonen om de farmacokinetische en farmacodynamische eigenschappen van Exubera, versus subcutane injectie van normale mensen insuline. De farmacokinetische en farmacodynamische eigenschappen van Exubera waren vergelijkbaar tussen de twee populaties.
zwaarlijvigheid
De absorptie van Exubera is onafhankelijk van de BMI van de patiënt.
Nierinsufficiëntie
Het effect van nierinsufficiëntie op de farmacokinetiek van Exubera is niet onderzocht. Zorgvuldige glucosemonitoring en dosisaanpassingen van insuline kunnen nodig zijn bij patiënten met nierdisfunctie (zie VOORZORGSMAATREGELEN, Nierinsufficiëntie).
Leverinsufficiëntie
Het effect van leverinsufficiëntie op de farmacokinetiek van Exubera is niet onderzocht. Zorgvuldige glucosemonitoring en dosisaanpassingen van insuline kunnen nodig zijn bij patiënten met leverdisfunctie (zie VOORZORGSMAATREGELEN).
Zwangerschap
De absorptie van Exubera bij zwangere patiënten met zwangerschapsdiabetes en pre-zwangerschapsdiabetes type 2 was consistent met die bij niet-zwangere patiënten met type 2-diabetes (zie VOORZORGSMAATREGELEN).
Roken
Bij rokers zal de systemische blootstelling aan insuline voor Exubera naar verwachting 2 tot 5 maal hoger zijn dan bij niet-rokers. Exubera is gecontra-indiceerd bij patiënten die roken of stoppen met roken minder dan 6 maanden voorafgaand aan het starten van de behandeling met Exubera. Als een patiënt begint of begint met roken, moet Exubera onmiddellijk worden stopgezet vanwege het verhoogde risico op hypoglykemie en moet een alternatieve behandeling worden gebruikt (zie CONTRA).
In klinische onderzoeken met Exubera bij 123 patiënten (waarvan 69 rokers), ervoeren rokers een sneller optreden van glucoseverlagende werking, groter maximaal effect, en een groter totaal glucoseverlagend effect (vooral tijdens de eerste 2-3 uur na dosering), vergeleken met niet-rokers.
Passieve sigarettenrook
In tegenstelling tot de toename van de blootstelling aan insuline na actief roken, wanneer Exubera werd toegediend aan 30 gezonde niet-rokende vrijwilligers na 2 uren blootstelling aan passieve sigarettenrook in een gecontroleerde experimentele setting, waren de AUC en Cmax van insuline verminderd met ongeveer 20% en 30%, respectievelijk. De farmacokinetiek van Exubera is niet onderzocht bij niet-rokers die chronisch worden blootgesteld aan passieve sigarettenrook.
Patiënten met onderliggende longziekten
Het gebruik van Exubera bij patiënten met onderliggende longziekte, zoals astma of COPD, wordt niet aanbevolen omdat de veiligheid en werkzaamheid van Exubera bij deze populatie niet zijn vastgesteld (zie WAARSCHUWINGEN). Het gebruik van Exubera is gecontra-indiceerd bij patiënten met een onstabiele of slecht gecontroleerde longziekte, vanwege brede variaties in longfunctie die de absorptie van Exubera kunnen beïnvloeden en het risico op hypoglykemie kunnen verhogen of hyperglykemie (zie CONTRA).
In een farmacokinetisch onderzoek bij 24 niet-diabetespatiënten met milde astma, is de absorptie van insuline na toediening van Exubera was bij afwezigheid van behandeling met een luchtwegverwijder ongeveer 20% lager dan de absorptie die werd waargenomen bij personen zonder astma. In een onderzoek bij 24 niet-diabetische proefpersonen met chronische obstructieve longziekte (COPD), de systemische blootstelling na toediening van Exubera was ongeveer twee keer hoger dan die bij normale proefpersonen zonder COPD (zie VOORZORGSMAATREGELEN).
Toediening van albuterol 30 minuten voorafgaand aan toediening van Exubera bij niet-diabetici met zowel milde astma (n = 36) als matig astma (n = 31) resulteerde in een gemiddelde toename van de AUC en Cmax van insuline tussen 25 en 50% vergeleken met wanneer Exubera alleen werd toegediend (zie VOORZORGSMAATREGELEN).
top
Klinische studies
De veiligheid en werkzaamheid van Exubera is onderzocht bij ongeveer 2500 volwassen patiënten met diabetes type 1 en type 2. De primaire werkzaamheidsparameter voor de meeste onderzoeken was glycemische controle, zoals gemeten aan de hand van de reductie vanaf baseline in hemoglobine A1c (HbA1c).
Type 1 diabetes
Een 24 weken durende, gerandomiseerde, open-label, actieve controle studie (studie A) werd uitgevoerd bij patiënten met diabetes type 1 om de veiligheid en werkzaamheid van Exubera driemaal daags pre-maaltijd (TID) toegediend met een enkele nachtelijke injectie Humulin® U Ultralente® (humane insuline uitgebreide zinksuspensie) (n = 136). De vergelijkingsbehandeling was subcutane reguliere humane insuline tweemaal daags toegediend (BID) (voor het ontbijt en voor het avondeten) met BID-injectie van NPH humane insuline (humane insuline isofaan suspensie) (n = 132). In deze studie was de gemiddelde leeftijd 38,2 jaar (spreiding: 20-64) en 52% van de proefpersonen was man.
Een tweede 24 weken durende, gerandomiseerde, open-label, actieve controle studie (studie B) werd uitgevoerd bij patiënten met type 1 diabetes om de veiligheid en werkzaamheid van Exubera (n = 103) vergeleken met subcutane normale humane insuline (n = 103) bij toediening van TID voorafgaand aan maaltijden. In beide behandelarmen werd aan NPH humane insuline BID ('s morgens en voor het slapengaan) toegediend als basale insuline. In deze studie was de gemiddelde leeftijd 38,4 jaar (spreiding: 19-65) en 54% van de proefpersonen was man.
In elke studie waren de afname van HbA1c en de tarieven van hypoglykemie vergelijkbaar voor de twee behandelingsgroepen. Met Exubera behandelde patiënten hadden een grotere afname in nuchtere plasmaglucose dan patiënten in de vergelijkingsgroep. Het percentage patiënten dat een HbA1c-niveau van <8% bereikt (per behandelingsactie van de American Diabetes Association) Niveau ten tijde van de studie) en een HbA1c-niveau van <7% was vergelijkbaar tussen de twee behandelingsgroepen. De resultaten voor onderzoeken A en B zijn weergegeven in tabel 2.
Tabel 2: Resultaten van twee 24-weekse, actieve controle, open-label onderzoeken bij patiënten met diabetes type 1 (onderzoeken A en B)
| Studie A | Studie B | |||
|---|---|---|---|---|
| Exubera (TID) + UL (QD) | SC R (BIED) + NPH (BIED) | Exubera (TID) + NPH (BID) | SC R (TID) + NPH (BID) | |
| Steekproefgrootte | 136 | 132 | 103 | 103 |
| UL = Humuline® U Ultralente®; SC R = subcutane normale humane insuline | ||||
| ||||
| HbA1c (%) | ||||
| Baseline gemiddelde | 7.9 | 8.0 | 7.8 | 7.8 |
| Adj. gemiddelde verandering ten opzichte van baseline | -0.2 | -0.4 | -0.3 | -0.2 |
| Exubera minus SC R* | 0.14 | -0.11 | ||
| 95% BI voor behandelingsverschil | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Nuchtere plasmaglucose (mg / dL) | ||||
| Baseline gemiddelde | 191 | 198 | 178 | 191 |
| Adj. gemiddelde verandering ten opzichte van baseline | -32 | -6 | -23 | 13 |
| Exubera minus SC R | -27 | -35 | ||
| 95% BI voor behandelingsverschil | (-47, -6) | (-58, -13) | ||
| 2-uur postprandiale glucoseconcentratie (mg / dL) | ||||
| Baseline gemiddelde | 283 | 305 | 273 | 293 |
| Adj. gemiddelde verandering ten opzichte van baseline | -21 | 14 | -1 | -3 |
| Exubera minus SC R | -35 | 2 | ||
| 95% BI voor behandelingsverschil | (-61, -8) | (-29, 32) | ||
| Patiënten met HbA aan het einde van de studie1c < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Patiënten met HbA aan het einde van de studie1c < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Lichaamsgewicht | ||||
| Baseline gemiddelde (kg) | 77.4 | 76.4 | 76.0 | 76.9 |
| Adj. gemiddelde verandering ten opzichte van de uitgangswaarde (kg) | 0.4 | 1.1 | 0.4 | 0.6 |
| Exubera minus SC R | -0.72 | -0.24 | ||
| 95% BI voor behandelingsverschil | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Einde van de studie dagelijkse insulinedosis | ||||
| Kortwerkende insuline | 13,4 mgc | 18.3 IE | 10,9 mgc | 25.7 IE |
| Langwerkende insuline | 26.4 IE | 37.1 IE | 31.5 IE | 31.9 IE |
Type 2 diabetes
Monotherapie bij patiënten niet optimaal gecontroleerd met dieet- en oefeningsbehandeling
Een 12 weken durende, gerandomiseerde, open-label, actieve controle studie (studie C) werd uitgevoerd bij patiënten met type 2 diabetes niet optimaal gecontroleerd met dieet en lichaamsbeweging, het beoordelen van de veiligheid en werkzaamheid van TID Exubera vóór de maaltijd (n = 75) in vergelijking met een insuline-sensibiliserend middel. In deze studie was de gemiddelde leeftijd 53,7 jaar (bereik: 28-80), 55% van de proefpersonen waren man en de gemiddelde body mass index was 32,3 kg / m2.
Na 12 weken, HbA1c niveaus bij patiënten behandeld met Exubera daalden met 2,2% (SD = 1,0) ten opzichte van een uitgangswaarde van 9,5% (SD = 1,1). Het percentage patiënten dat met Exubera wordt behandeld en een HbA aan het einde van de studie bereikt1c niveau van <8% gestegen tot 82,7%. Het percentage patiënten dat met Exubera wordt behandeld en een HbA aan het einde van de studie bereikt1c niveau van
Monotherapie en aanvullende therapie bij patiënten die eerder werden behandeld met orale therapie
Een 12 weken durende, gerandomiseerde, open-label, actieve controle studie (studie D) werd uitgevoerd bij patiënten met type 2 diabetes die momenteel werd behandeld, maar die slecht onder controle was, met twee orale middelen (OA). Baseline OA's omvatten een insulinesecretagoog en metformine of een thiazolidinedion. Patiënten werden gerandomiseerd naar een van de drie armen: alleen OA-therapie voortzetten (n = 96), overschakelen naar TID Exubera voor de maaltijd monotherapie (n = 102) of toevoeging van TID Exubera vóór de maaltijd aan voortgezette OA-therapie (n = 100). In deze studie was de gemiddelde leeftijd 57.4 jaar (spreiding: 33-80), 66% van de proefpersonen waren man en de gemiddelde body mass index was 30 kg / m2.
Exubera monotherapie en Exubera in combinatie met OA-therapie waren superieur aan OA-therapie alleen bij het verminderen van HbA1c niveaus vanaf baseline. De percentages hypoglykemie voor de twee Exubera-behandelingsgroepen waren iets hoger dan in de groep met alleen OA-therapie. Vergeleken met alleen OA-therapie, het percentage patiënten dat een HbA bereikt1c niveau van <8% (per behandelingsniveau van de American Diabetes Association-behandeling ten tijde van het verloop van de studie) en een HbA1c niveau van <7% was hoger voor patiënten die werden behandeld met Exubera monotherapie en Exubera in combinatie met OA-therapie. Patiënten in beide Exubera-behandelingsgroepen hadden grotere afnames in nuchtere plasmaglucose dan patiënten die alleen met OA-therapie werden behandeld. De resultaten voor onderzoek D zijn weergegeven in tabel 3.
Tabel 3: Resultaten van een 12 weken durende, actieve controle, open-label studie bij patiënten met diabetes type 2 niet optimaal gecontroleerd met dubbele orale therapie (onderzoek D)
| Studie D | Exubera monotherapie | OA* | Exubera + OA's |
|---|---|---|---|
| Steekproefgrootte | 102 | 96 | 100 |
| |||
| HbA1c (%) | |||
| Baseline gemiddelde | 9.3 | 9.3 | 9.2 |
| Adj. gemiddelde verandering ten opzichte van baseline | -1.4 | -0.2 | -1.9 |
| Exubera-groep minus OA's†| -1.18†,c, § | -1.67†, ¶, § | |
| 95% BI voor behandelingsverschil | (-1.41, -0.95) | (-1.90, -1.44) | |
| Nuchtere plasmaglucose (mg / dL) | |||
| Baseline gemiddelde | 203 | 203 | 195 |
| Adj. gemiddelde verandering ten opzichte van baseline | -23 | 1 | -53 |
| Exubera-groep minus OA's | -24c | -53 ¶ | |
| 95% BI voor behandelingsverschil | (-36, -11) | (-66, -41) | |
| Patiënten met HbA aan het einde van de studie1c < 8%# | 55.9% | 18.8% | 86.0% |
| Patiënten met HbA aan het einde van de studie1c < 7% | 16.7% | 1.0% | 32.0% |
| Lichaamsgewicht | |||
| Baseline gemiddelde (kg) | 89.5 | 88.0 | 88.6 |
| Adj. gemiddelde verandering ten opzichte van de uitgangswaarde (kg) | 2.8 | 0.0 | 2.7 |
| Exubera-groep minus OA's | 2.80c | 2.75 ¶ | |
| 95% BI voor behandelingsverschil | (1.94, 3.65) | (1.89, 3.61) |
Een 24 weken durende, gerandomiseerde, open-label, actieve controle studie (studie E) werd uitgevoerd bij patiënten met type 2 diabetes, die momenteel sulfonylureumtherapie krijgen. Deze studie was bedoeld om de veiligheid en werkzaamheid van de voortzetting van Exubera vóór de maaltijd te beoordelen sulfonylureumtherapie (n = 214) vergeleken met de toevoeging van pre-maaltijd metformine aan voortgezette sulfonylureumtherapie (n = 196). Patiënten werden gestratificeerd volgens hun HbA1c in week -1. Twee lagen werden gedefinieerd: een laag HbA1c-stratum (HbA1c â ‰ ¥ 8% tot â ‰ ¤9.5%) en een hoge HbA1c stratum (HbA1c > 9,5 tot â ‰ ¤12%).
Exubera in combinatie met sulfonylureum was beter dan metformine en sulfonylureum bij het verlagen van HbA1c-waarden ten opzichte van de uitgangswaarde in de hoge stratum-groep. Exubera in combinatie met sulfonylureum was vergelijkbaar met metformine in combinatie met sulfonylureum bij het verlagen van HbA1c-waarden ten opzichte van de uitgangswaarde in de lage stratum-groep. De snelheid van hypoglykemie was hoger na de toevoeging van Exubera aan sulfonylureum dan na de toevoeging van metformine aan sulfonylureum. Het percentage patiënten dat de streefwaarden van HbA1c van 8% en 7% bereikte, was vergelijkbaar tussen de behandelingsgroepen in beide lagen, evenals een vermindering van de nuchtere plasmaglucose (zie Tabel 4).
Nog een 24-weken durende, gerandomiseerde, open-label, actieve controle studie (studie F) werd uitgevoerd bij patiënten met diabetes type 2, die momenteel metformine-therapie krijgen. Deze studie was bedoeld om de veiligheid en werkzaamheid van de voortzetting van Exubera vóór de maaltijd te beoordelen metformine-therapie (n = 234) vergeleken met de toevoeging van glibenclamide vóór de maaltijd aan voortgezette metformine-therapie (n = 222). Proefpersonen in deze studie werden ook gestratificeerd naar een van de twee lagen zoals gedefinieerd in studie E.
Exubera in combinatie met metformine was superieur aan glibenclamide en metformine bij het verminderen van HbA1c waarden vanaf baseline en het bereiken van doel-HbA1c waarden in de hoge stratum-groep. Exubera in combinatie met metformine was vergelijkbaar met glibenclamide in combinatie met metformine bij het verminderen van HbA1c waarden vanaf baseline en het bereiken van doel-HbA1c waarden in de lage stratum-groep. De snelheid van hypoglykemie was iets hoger na de toevoeging van Exubera aan metformine dan na de toevoeging van glibenclamide aan metformine. De afname van de nuchtere plasmaglucose was vergelijkbaar tussen de behandelingsgroepen (zie Tabel 4).
Tabel 4: Resultaten van twee 24 weken durende, actieve controle, open-label onderzoeken bij patiënten met diabetes type 2 eerder met orale medicamenteuze therapie (onderzoek E en F)
| Studie E | Studie F | |||||||
|---|---|---|---|---|---|---|---|---|
| Exubera + SU* | leerde kennen*+ SU* | Exubera + SU* | leerde kennen*+ SU* | Exubera + Met* | Gli* + Met* | Exubera + Met* | Gli* + Met* | |
| Hoge laag†| Laag stratum†| Hoge laag†| Laag stratum†| |||||
| Steekproefgrootte | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| HbA1c (%) | ||||||||
| Baseline gemiddelde | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Adj. gemiddelde verandering ten opzichte van baseline | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Exubera minus OAc | -0.38c, § | -0.07 | -0.37c, ¶ | 0.04 | ||||
| 95% BI voor behandelingsverschil | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Nuchtere plasmaglucose (mg / dL) | ||||||||
| Baseline gemiddelde | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Gemiddelde verandering ten opzichte van baseline | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Exubera minus OA | 1 | 4 | -2 | 4 | ||||
| 95% BI voor behandelingsverschil | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Proefpersonen met einde van de studie HbA1c < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Proefpersonen met einde van de studie HbA1c < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Lichaamsgewicht | ||||||||
| Baseline gemiddelde (kg) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Adj. gemiddelde verandering ten opzichte van de uitgangswaarde (kg) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Exubera minus OA | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| 95% BI voor behandelingsverschil | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Gebruik bij patiënten die eerder zijn behandeld met subcutane insuline
Een 24-weken durende, gerandomiseerde, open-label, actieve controle studie (studie G) werd uitgevoerd bij met insuline behandelde patiënten met type 2 diabetes om de veiligheid en werkzaamheid van Exubera toegediend TID vóór de maaltijd te beoordelen met een enkele nachtelijke injectie van Humulin® U Ultralente® (n = 146) vergeleken met subcutane reguliere humane insuline toegediend BID (pre-breakfast en pre-dinner) met BID-injectie van NPH humane insuline (n = 149). In deze studie was de gemiddelde leeftijd 57,5 jaar (spreiding: 23-80), 66% van de proefpersonen was man en de gemiddelde body mass index was 30,3 kg / m2.
De verminderingen vanaf baseline in HbA1c, percentage patiënten dat een HbA bereikt1c niveau van <8% (per behandelingsniveau van de American Diabetes Association-behandeling ten tijde van het verloop van de studie) en een HbA1c niveau van <7%, evenals de tarieven van hypoglykemie, waren vergelijkbaar tussen behandelingsgroepen. Met Exubera behandelde patiënten hadden een grotere afname in nuchtere plasmaglucose dan patiënten in de vergelijkingsgroep. De resultaten voor onderzoek G zijn weergegeven in tabel 5.
Tabel 5: Resultaten van een 24 weken durende, actieve controle, open-label studie bij patiënten met diabetes type 2, eerder behandeld met subcutane insuline (onderzoek G)
| Studie G | Exubera (TID) + UL (QD) | SC R (BIED) + NPH (BIED) |
|---|---|---|
| Steekproefgrootte | 146 | 149 |
| UL = Humuline® U Ultralente®; SC R = subcutane normale humane insuline | ||
| ||
| HbA1c (%) | ||
| Baseline gemiddelde | 8.1 | 8.2 |
| Adj. gemiddelde verandering ten opzichte van baseline | -0.7 | -0.6 |
| Exubera minus SC R* | -0.07 | |
| 95% BI voor behandelingsverschil | (-0.31, 0.17) | |
| Nuchtere plasmaglucose (mg / dL) | ||
| Baseline gemiddelde | 152 | 159 |
| Adj. gemiddelde verandering ten opzichte van baseline | -22 | -6 |
| Exubera minus SC R | -16.36 | |
| 95% BI voor behandelingsverschil | (-27.09, -5.36) | |
| Patiënten met HbA aan het einde van de studie1c < 8%†| 76.0% | 69.1% |
| Patiënten met HbA aan het einde van de studie1c < 7% | 45.2% | 32.2% |
| Lichaamsgewicht | ||
| Baseline gemiddelde (kg) | 90.6 | 89.0 |
| Adj. gemiddelde verandering ten opzichte van de uitgangswaarde (kg) | 0.1 | 1.3 |
| Exubera minus SC R | -1.28 | |
| 95% BI voor behandelingsverschil | (-1.96, -0.60) | |
| Einde van de studie dagelijkse insulinedosis | ||
| Kortwerkende insuline | 16,6 mgc | 25.5 IE |
| Langwerkende insuline | 37.9 IE | 52.3 IE |
top
Aanwijzingen en gebruik
Exubera is geïndiceerd voor de behandeling van volwassen patiënten met diabetes mellitus voor de controle van hyperglykemie. Exubera heeft een begin van werking vergelijkbaar met snelwerkende insuline-analogen en heeft een duur van glucoseverlagende activiteit vergelijkbaar met subcutaan toegediende reguliere humane insuline. Bij patiënten met diabetes type 1 moet Exubera worden gebruikt bij behandelingen met een langer werkende insuline. Bij patiënten met diabetes type 2 kan Exubera worden gebruikt als monotherapie of in combinatie met orale middelen of langer werkende insulines.
top
Contra
Exubera is gecontra-indiceerd bij patiënten die overgevoelig zijn voor Exubera of een van de hulpstoffen.
Exubera is gecontra-indiceerd bij patiënten die roken of stoppen met roken minder dan 6 maanden voorafgaand aan het starten van de behandeling met Exubera. Als een patiënt begint of begint met roken, moet Exubera onmiddellijk worden stopgezet vanwege het verhoogde risico op hypoglykemie en moet een alternatieve behandeling worden gebruikt (zie KLINISCHE FARMACOLOGIE, Speciale populaties, Roken). De veiligheid en werkzaamheid van Exubera bij patiënten die roken zijn niet vastgesteld.
Exubera is gecontra-indiceerd bij patiënten met instabiele of slecht gecontroleerde longziekte, vanwege grote variaties in longfunctie die de absorptie van Exubera kan beïnvloeden en het risico op hypoglykemie kan verhogen of hyperglykemie.
top
waarschuwingen
Exubera verschilt van gewone humane insuline door zijn snelle werking. Bij gebruik als maaltijdinsuline moet de dosis Exubera binnen 10 minuten vóór een maaltijd worden gegeven.
Hypoglykemie is de meest gemelde bijwerking van insulinetherapie, waaronder Exubera. De timing van hypoglykemie kan verschillen tussen verschillende insulinesamenstellingen.
Patiënten met type 1 diabetes hebben ook een langerwerkende insuline nodig om voldoende glucose onder controle te houden.
Elke verandering van insuline dient voorzichtig te geschieden en alleen onder medisch toezicht. Veranderingen in insuline sterkte, fabrikant, type (bijv. Regulier, NPH, analogen) of soort (dier, mens) kunnen ertoe leiden dat de dosering moet worden gewijzigd. Gelijktijdige orale antidiabetische behandeling moet mogelijk worden aangepast.
Glucosebewaking wordt aanbevolen voor alle patiënten met diabetes.
Vanwege het effect van Exubera op de longfunctie, moeten alle patiënten de longfunctie laten beoordelen voordat de behandeling met Exubera wordt gestart (zie VOORZORGSMAATREGELEN: Longfunctie).
Het gebruik van Exubera bij patiënten met onderliggende longziekte, zoals astma of COPD, wordt niet aanbevolen omdat de veiligheid en werkzaamheid van Exubera bij deze populatie niet zijn vastgesteld (zie VOORZORGSMAATREGELEN: Onderliggende longziekte).
In klinische onderzoeken met Exubera zijn er 6 nieuw gediagnosticeerde gevallen van primaire longmaligniteiten bij met Exubera behandelde patiënten en 1 nieuw gediagnosticeerde geval bij met comparator behandelde patiënten. Er is ook 1 postmarketingrapport geweest van een primaire longmaligniteit bij een met Exubera behandelde patiënt. In gecontroleerde klinische onderzoeken met Exubera was de incidentie van nieuwe primaire longkanker per 100 patiëntjaren blootstelling aan onderzoeksgeneesmiddel 0,13 (5 gevallen meer dan 3900 patiëntjaren) voor met Exubera behandelde patiënten en 0,02 (1 geval meer dan 4100 patiëntjaren) voor met comparator behandelde patiënten. Er waren te weinig gevallen om te bepalen of de opkomst van deze gebeurtenissen verband houdt met Exubera. Alle patiënten bij wie de diagnose longkanker was gesteld, hadden in het verleden sigaretten roken.
top
Voorzorgsmaatregelen
Algemeen
Zoals met alle insulinepreparaten, kan het tijdsverloop van Exubera-actie bij verschillende personen of op verschillende tijdstippen bij dezelfde persoon variëren. Aanpassing van de dosering van insuline kan nodig zijn als patiënten hun fysieke activiteit of hun gebruikelijke maaltijdplan wijzigen. De insulinebehoefte kan worden gewijzigd tijdens bijkomende omstandigheden zoals ziekte, emotionele stoornissen of stress.
hypoglykemie
Zoals bij alle insulinepreparaten, kunnen hypoglykemische reacties gepaard gaan met de toediening van Exubera. Snelle veranderingen in serumglucoseconcentraties kunnen symptomen veroorzaken die vergelijkbaar zijn met hypoglykemie bij personen met diabetes, ongeacht de glucosewaarde. Vroege waarschuwingssymptomen van hypoglykemie kunnen onder bepaalde omstandigheden, zoals lang, anders of minder uitgesproken zijn duur van diabetes, diabetische zenuwziekte, gebruik van medicijnen zoals bètablokkers of versterkte diabetescontrole (zien VOORZORGSMAATREGELEN: Geneesmiddelinteracties). Dergelijke situaties kunnen leiden tot ernstige hypoglykemie (en mogelijk bewustzijnsverlies) voordat patiënten zich bewust worden van hypoglykemie.
Nierinsufficiëntie
Er zijn geen onderzoeken uitgevoerd bij patiënten met nierinsufficiëntie. Net als bij andere insulinepreparaten kunnen de dosisvereisten voor Exubera worden verlaagd bij patiënten met nierinsufficiëntie (zie KLINISCHE FARMACOLOGIE, Speciale populaties).
Leverinsufficiëntie
Er zijn geen onderzoeken uitgevoerd bij patiënten met leverinsufficiëntie. Net als bij andere insulinepreparaten kunnen de dosisvereisten voor Exubera worden verlaagd bij patiënten met leverinsufficiëntie (zie KLINISCHE FARMACOLOGIE, Speciale populaties).
Allergie
Systemische allergie
In klinische onderzoeken was de totale incidentie van allergische reacties bij patiënten die met Exubera werden behandeld vergelijkbaar met die bij patiënten die subcutane regimes gebruiken met reguliere humane insuline.
Net als bij andere insulinepreparaten kan zeldzame, maar mogelijk ernstige, gegeneraliseerde allergie voor insuline optreden, die dit kan veroorzaken uitslag (inclusief jeuk) over het hele lichaam, kortademigheid, piepende ademhaling, bloeddrukdaling, snelle pols of zweten. Ernstige gevallen van gegeneraliseerde allergie, waaronder anafylactische reacties, kunnen levensbedreigend zijn. Als dergelijke reacties optreden bij Exubera, moet Exubera worden gestopt en moeten alternatieve therapieën worden overwogen.
Productie van antilichamen
Insuline-antilichamen kunnen zich ontwikkelen tijdens de behandeling met alle insulinepreparaten inclusief Exubera. In klinische onderzoeken van Exubera, waarbij de comparator subcutane insuline was, verhoogde insuline-antilichaamspiegels (zoals blijkt uit analyses van insuline bindende activiteit) waren significant groter voor patiënten die Exubera kregen dan voor patiënten die subcutane insuline kregen enkel en alleen. Geen klinische gevolgen van deze antilichamen werden geïdentificeerd gedurende de periode van klinische studies met Exubera; de klinische betekenis op lange termijn van deze toename in antilichaamvorming is echter onbekend.
ademhalings
Longfunctie
In klinische onderzoeken met een duur tot twee jaar vertoonden patiënten die met Exubera werden behandeld een grotere afname van de longfunctie, specifiek het geforceerde uitademingsvolume in één seconde (FEV1) en de koolmonoxide diffunderende capaciteit (DLCO), dan met comparator behandeld patiënten. Het gemiddelde verschil in behandelingsgroep in longfunctie ten gunste van de vergelijkingsgroep, werd genoteerd binnen de eerste weken van behandeling met Exubera, en veranderde niet gedurende de behandelingsperiode van twee jaar (Zien BIJWERKINGEN: Longfunctie).
Tijdens de gecontroleerde klinische onderzoeken ervoeren individuele patiënten een opmerkelijke afname van de longfunctie in beide behandelingsgroepen. Een daling van de uitgangswaarde FEV1 van â ‰ ¥ 20% bij de laatste waarneming trad op bij 1,5% van de met Exubera behandelde patiënten en bij 1,3% van de met comparator behandelde patiënten. Een daling ten opzichte van baseline DLCO van â ‰ ¥ 20% bij de laatste waarneming trad op bij 5,1% van de met Exubera behandelde patiënten en bij 3,6% van de met comparator behandelde patiënten.
Vanwege het effect van Exubera op de longfunctie moeten alle patiënten spirometrie (FEV1) laten beoordelen voordat de behandeling met Exubera wordt gestart. Beoordeling van DLCO moet overwogen worden. De werkzaamheid en veiligheid van Exubera bij patiënten met FEV bij aanvang1 of DLCO <70% voorspeld is niet vastgesteld en het gebruik van Exubera bij deze populatie wordt niet aanbevolen.
Beoordeling van de longfunctie (bijv. Spirometrie) wordt aanbevolen na de eerste 6 maanden van de therapie en jaarlijks daarna, zelfs bij afwezigheid van longsymptomen. Bij patiënten met een daling van â ‰ ¥ 20% in FEV1 ten opzichte van de uitgangswaarde, moeten longfunctietests worden herhaald. Als de daling van â ‰ ¥ 20% ten opzichte van baseline FEV1 wordt bevestigd, moet Exubera worden stopgezet. De aanwezigheid van longsymptomen en mindere dalingen van de longfunctie kunnen een frequentere monitoring van de longfunctie vereisen en het overwegen van het staken van Exubera.
Onderliggende longziekte
Het gebruik van Exubera bij patiënten met onderliggende longaandoeningen, zoals astma of COPD, wordt niet aanbevolen omdat de werkzaamheid en veiligheid van Exubera bij deze populatie niet zijn vastgesteld.
bronchospasme
Bronchospasme is zelden gemeld bij patiënten die Exubera gebruiken. Patiënten die een dergelijke reactie ervaren, moeten stoppen met Exubera en onmiddellijk een arts raadplegen. Het opnieuw toedienen van Exubera vereist een zorgvuldige risico-evaluatie en mag alleen worden gedaan onder nauw medisch toezicht met geschikte klinische faciliteiten beschikbaar.
Bijkomende aandoeningen van de luchtwegen
Exubera is tijdens klinische onderzoeken toegediend aan patiënten met bijkomende luchtwegaandoeningen (bijv. Bronchitis, infecties van de bovenste luchtwegen, rhinitis). Bij patiënten met deze aandoeningen stopte 3-4% de behandeling met Exubera tijdelijk. Er werd geen verhoogd risico op hypoglykemie of verslechterde glykemische controle waargenomen bij met Exubera behandelde patiënten vergeleken met patiënten die werden behandeld met subcutane insuline. Tijdens bijkomende aandoeningen van de luchtwegen kan nauwlettend toezicht op de bloedglucoseconcentraties en dosisaanpassing nodig zijn.
Informatie voor patiënten
Patiënten moeten worden geïnstrueerd over zelfmanagementprocedures, waaronder glucosemonitoring; juiste Exubera-inhalatietechniek; en hypoglykemie en hyperglykemie management. Patiënten moeten worden geïnstrueerd over het omgaan met speciale situaties, zoals bijkomende omstandigheden (ziekte, stress of emotioneel) stoornissen), een onvoldoende of overgeslagen insulinedosis, onbedoelde toediening van een verhoogde insulinedosis, onvoldoende voedselinname, of overgeslagen maaltijden.
Patiënten moeten worden geïnformeerd dat in klinische onderzoeken de behandeling met Exubera werd geassocieerd met kleine, niet-progressieve gemiddelde dalingen van de longfunctie ten opzichte van vergelijkende behandelingen. Vanwege het effect van Exubera op de longfunctie, worden longfunctietesten aanbevolen voordat de behandeling met Exubera wordt gestart. Na het starten van de therapie worden periodieke longfunctietests aanbevolen (zie VOORZORGSMAATREGELEN Luchtwegen, longfunctie).
Patiënten moeten hun arts informeren als ze een voorgeschiedenis van longziekte hebben, omdat het gebruik van Exubera niet wordt aanbevolen in patiënten met onderliggende longziekte (bijv. astma of COPD), en is gecontra-indiceerd bij patiënten met een slecht gecontroleerde long ziekte.
Vrouwen met diabetes moeten het advies krijgen om hun arts te informeren als ze zwanger zijn of een zwangerschap overwegen.
top
Geneesmiddelinteracties
Een aantal stoffen beïnvloedt het glucosemetabolisme en kan aanpassing van de insulinedosis en met name nauwlettend toezicht vereisen.
Hierna volgen voorbeelden van stoffen die het bloedglucoseverlagende effect van insuline kunnen verminderen en die kunnen leiden tot hyperglykemie: corticosteroïden, danazol, diazoxide, diuretica, sympathicomimetische middelen (bijv. epinefrine, albuterol, terbutaline), glucagon, isoniazide, fenothiazinederivaten, somatropine, schildklierhormonen, oestrogenen, progestagenen (bijv. in orale anticonceptiva), proteaseremmers en atypische antipsychotische medicijnen (bijv. olanzapine en clozapine).
Hierna volgen voorbeelden van stoffen die het bloedglucoseverlagende effect van insuline en de gevoeligheid voor hypoglykemie kunnen vergroten: oraal antidiabetische producten, ACE-remmers, disopyramide, fibraten, fluoxetine, MAO-remmers, pentoxifylline, propoxyfeen, salicylaten en sulfonamide antibiotica.
Bètablokkers, clonidine, lithiumzouten en alcohol kunnen het bloedglucoseverlagende effect van insuline verhogen of verminderen. Pentamidine kan hypoglykemie veroorzaken, wat soms kan worden gevolgd door hyperglykemie.
Onder invloed van sympatholytische geneesmiddelen zoals bètablokkers, clonidine, guanethidine en reserpine kunnen bovendien de tekenen en symptomen van hypoglykemie verminderd of afwezig zijn.
Bronchusverwijders en andere geïnhaleerde producten kunnen de absorptie van geïnhaleerde humane insuline veranderen (zie KLINISCHE FARMACOLOGIE, Speciale populaties). Consistente timing van de dosering van bronchusverwijders ten opzichte van Exubera-toediening, nauwgezette controle van bloedglucoseconcentraties en dosistitratie worden aanbevolen.
Carcinogenese, mutagenese, aantasting van de vruchtbaarheid
Er zijn geen tweejarige carcinogeniteitsstudies bij dieren uitgevoerd. Insuline was niet mutageen in de Ames bacteriële reverse-mutatietest in aanwezigheid en afwezigheid van metabole activering.
Bij Sprague-Dawley-ratten werd een toxiciteitsonderzoek met herhaalde doses van 6 maanden uitgevoerd met insuline-inhalatiepoeder in doses tot 5,8 mg / kg / dag (vergeleken met de klinische startdosis van 0,15 mg / kg / dag, de hoge dosis rat was 39 keer of 8,3 keer de klinische dosis, gebaseerd op een vergelijking van mg / kg of mg / m2 lichaamsoppervlak). Bij Cynomolgus-apen werd een toxiciteitsonderzoek met herhaalde doses van 6 maanden uitgevoerd met geïnhaleerde insuline in doses tot 0,64 mg / kg / dag. Vergeleken met de klinische startdosis van 0,15 mg / kg / dag, was de hoge dosis aap 4,3 of 1,4 keer de klinische dosis, gebaseerd op een vergelijking van mg / kg of mg / m2 lichaamsoppervlak. Dit waren maximale getolereerde doses op basis van hypoglykemie.
In vergelijking met controledieren waren er bij beide soorten geen behandelingsgerelateerde nadelige effecten op de longfunctie, grove of microscopische morfologie van de luchtwegen of bronchiale lymfeklieren. Evenzo was er bij beide soorten geen effect op celproliferatie-indices in het alveolaire of bronchiolaire gebied van de long.
Omdat recombinant humane insuline identiek is aan het endogene hormoon, zijn reproductieve / vruchtbaarheidsstudies niet uitgevoerd bij dieren.
Zwangerschap
Teratogene effecten
Zwangerschap Categorie C
Er zijn geen reproductiestudies bij dieren uitgevoerd met Exubera. Het is ook niet bekend of Exubera schade aan de foetus kan veroorzaken bij toediening aan een zwangere vrouw of dat Exubera het voortplantingsvermogen kan beïnvloeden. Exubera mag alleen aan een zwangere vrouw worden gegeven als dit duidelijk nodig is.
Moeders die borstvoeding geven
Veel medicijnen, waaronder humane insuline, worden uitgescheiden in moedermelk. Om deze reden is voorzichtigheid geboden wanneer Exubera wordt toegediend aan een vrouw die borstvoeding geeft. Patiënten met diabetes die borstvoeding geven, kunnen aanpassingen van de Exubera-dosis, het maaltijdplan of beide nodig hebben.
Gebruik bij kinderen
De veiligheid en werkzaamheid van Exubera op de lange termijn bij pediatrische patiënten zijn niet vastgesteld (zie KLINISCHE FARMACOLOGIE, Speciale populaties).
Geriatrisch gebruik
In gecontroleerde fase 2/3 klinische onderzoeken (n = 1975) werd Exubera toegediend aan 266 patiënten - ¥ 65 jaar oud en 30 patiënten - ¥ 75 jaar oud. De meerderheid van deze patiënten had diabetes type 2. De verandering in HbA1C en tarief van hypoglykemie verschilde niet naar leeftijd.
top
Bijwerkingen
De veiligheid van Exubera alleen, of in combinatie met subcutane insuline of orale middelen, is geweest geëvalueerd bij ongeveer 2500 volwassen patiënten met type 1 of type 2 diabetes die werden blootgesteld Exubera. Ongeveer 2000 patiënten werden langer dan 6 maanden blootgesteld aan Exubera en meer dan 800 patiënten werden langer dan 2 jaar blootgesteld.
Niet-ademhalingsbijwerkingen
Niet-respiratoire bijwerkingen gemeld bij â ‰ ¥ 1% van 1977 met Exubera behandelde patiënten in gecontroleerde fase 2/3 klinische onderzoeken, ongeacht de oorzaak, omvatten (maar zijn niet beperkt tot) het volgende:
Metabolisch en voedingswaarde: hypoglykemie (zie WAARSCHUWINGEN en VOORZORGSMAATREGELEN)
Lichaam als geheel: pijn op de borst
Spijsvertering: droge mond
Speciale zintuigen: otitis media (type 1 pediatrische diabetici)
hypoglykemie
De percentages en incidentie van hypoglykemie waren vergelijkbaar tussen Exubera en subcutane normale humane insuline bij patiënten met type 1 en type 2 diabetes. Bij type 2-patiënten die niet adequaat werden gecontroleerd met een enkele orale therapie, de toevoeging van Exubera werd geassocieerd met een hogere mate van hypoglykemie dan de toevoeging van een tweede orale middel.
Pijn op de borst
Een reeks verschillende borstsymptomen werd gerapporteerd als bijwerkingen en werd gegroepeerd onder de niet-specifieke term pijn op de borst. Deze gebeurtenissen traden op bij 4,7% van de met Exubera behandelde patiënten en 3,2% van de patiënten in vergelijkende groepen. De meerderheid (> 90%) van deze voorvallen werd gemeld als mild of matig. Twee patiënten in de Exubera en één in de vergelijkingsgroep stopten met de behandeling vanwege pijn op de borst. De incidentie van alle causale bijwerkingen gerelateerd aan kransslagaderaandoeningen, zoals angina pectoris of myocardinfarct was vergelijkbaar in de Exubera (0,7% angina pectoris; 0,7% myocardinfarct) en comparator (1,3% angina pectoris; 0,7% myocardinfarct) behandelingsgroepen.
Droge mond
Droge mond werd gemeld bij 2,4% van de met Exubera behandelde patiënten en bij 0,8% van de patiënten in vergelijkende groepen. Bijna alle (> 98%) van de droge mond was mild of matig. Geen van de patiënten stopte met de behandeling vanwege een droge mond.
Oorgebeurtenissen bij pediatrische diabetici
Pediatrische type 1-diabetici in Exubera-groepen ondervonden vaker bijwerkingen gerelateerd aan het oor dan pediatrische type 1-diabetici in behandelingsgroepen die alleen subcutane insuline kregen. Deze gebeurtenissen omvatten otitis media (Exubera 6,5%; SC 3,4%), oorpijn (Exubera 3,9%; SC 1,4%) en ooraandoeningen (Exubera 1,3%; SC 0%).
Bijwerkingen van de luchtwegen
Tabel 6 toont de incidentie van respiratoire bijwerkingen voor elke behandelingsgroep die werden gerapporteerd in â ‰ ¥ 1% van elke behandelingsgroep in gecontroleerde fase 2 en 3 klinische onderzoeken, ongeacht het oorzakelijk verband.
Tabel 6: Bijwerkingen van de luchtwegen gemeld in â ‰ ¥ 1% van elke behandelingsgroep in gecontroleerde fase 2 en 3 klinische onderzoeken, ongeacht de causaliteit
| Percentage patiënten dat gebeurtenis meldt | |||||
|---|---|---|---|---|---|
| Nadelige gebeurtenis | Type 1 diabetes | Type 2 diabetes | |||
| Exubera N = 698 |
SC N = 705 |
Exubera N = 1279 |
SC N = 488 |
OA N = 644 |
|
| SC = subcutane insuline-comparator; OA = comparatoren voor orale middelen | |||||
| Luchtweginfectie | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Hoest verhoogd | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| keelholteontsteking | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| rhinitis | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| sinusitis | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Ademhalingsstoornis | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| kortademigheid | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Sputum verhoogd | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| Bronchitis | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| Astma | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| epistaxis | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| keelontsteking | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| Longontsteking | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Voice Alteration | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
Hoesten
In 3 klinische onderzoeken rapporteerden patiënten die een hoestvragenlijst hadden ingevuld dat de hoest de neiging had binnen te komen seconden tot minuten na inhalatie van Exubera, was overwegend mild van ernst en was zelden productief in natuur. De incidentie van deze hoest nam af bij voortgezet gebruik van Exubera. In gecontroleerde klinische onderzoeken stopte 1,2% van de patiënten met de behandeling met Exubera vanwege hoest.
kortademigheid
Bijna alle (> 97%) dyspneu werd gemeld als mild of matig. Een klein aantal met Exubera behandelde patiënten (0,4%) staakte de behandeling vanwege dyspneu vergeleken met 0,1% van de met comparator behandelde patiënten.
Andere bijwerkingen aan de luchtwegen - faryngitis, verhoogde sputum en epistaxis
De meerderheid van deze voorvallen werd gemeld als mild of matig. Een klein aantal met Exubera behandelde patiënten stopte met de behandeling vanwege faryngitis (0,2%) en het sputum nam toe (0,1%); geen patiënten stopten met de behandeling vanwege epistaxis.
Longfunctie
Het effect van Exubera op de luchtwegen is geëvalueerd bij meer dan 3800 patiënten in gecontroleerde fase 2- en 3-klinische onderzoeken (waarin 1977 patiënten werden behandeld met Exubera). In gerandomiseerde, open-label klinische onderzoeken met een duur tot twee jaar, patiënten behandeld met Exubera vertoonde een grotere afname van de longfunctie, met name het geforceerde expiratoire volume in één seconde (FEV1) en de diffusiecapaciteit van koolmonoxide (DLCO), dan met comparator behandelde patiënten. De gemiddelde behandelingsgroepverschillen in FEV1 en DLCO, werden opgemerkt binnen de eerste paar weken van behandeling met Exubera en vorderden niet gedurende de behandelingsperiode van twee jaar. In één voltooide gecontroleerde klinische studie bij patiënten met diabetes type 2 na twee jaar behandeling met Exubera, vertoonden patiënten een oplossing voor het verschil in behandelingsgroep in FEV1 zes weken na stopzetting van de therapie. Resolutie van het effect van Exubera op de longfunctie bij patiënten met diabetes type 1 is niet onderzocht na langdurige behandeling.
Figuren 3 tot en met 6 tonen de gemiddelde FEV1 en DLCO verandering van nulmeting versus tijd van twee lopende gerandomiseerde, open-label, tweejarige studies bij 580 patiënten met type 1 en 620 patiënten met type 2 diabetes.
Figuur 3: Verandering van uitgangswaarde FEV1 (L) bij patiënten met diabetes type 1 (gemiddelde +/- standaardafwijking)
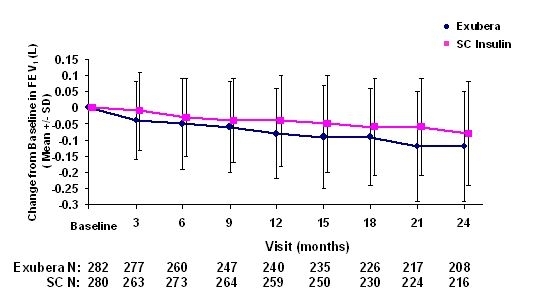
Figuur 4: Verandering van uitgangswaarde FEV1 (L) bij patiënten met diabetes type 2 (gemiddelde +/- standaardafwijking)

Na 2 jaar behandeling met Exubera bij patiënten met type 1 en type 2 diabetes, het verschil tussen behandelingsgroepen voor de gemiddelde verandering ten opzichte van baseline FEV1 was ongeveer 40 ml, ten gunste van de comparator.
Figuur 5: Verandering van uitgangswaarde DLco (ml / min / mmHg) bij patiënten met diabetes type 1 (gemiddelde +/- standaardafwijking)
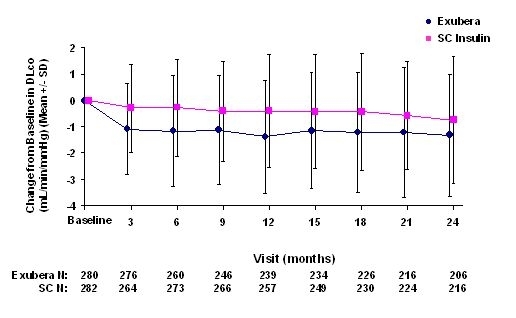
Figuur 6: Verandering van uitgangswaarde DLco (ml / min / mmHg) bij patiënten met diabetes type 2 (gemiddelde +/- standaardafwijking)
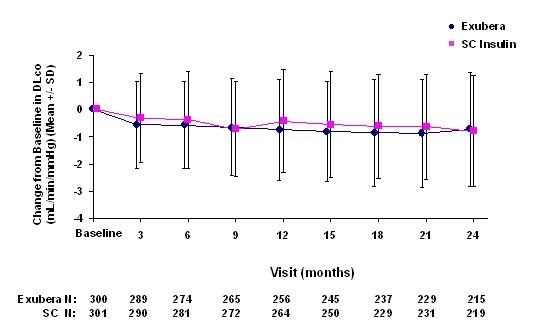
Na 2 jaar behandeling met Exubera was het verschil tussen de behandelingsgroepen voor de gemiddelde verandering ten opzichte van de uitgangswaarde DLCO was ongeveer 0,5 ml / min / mm Hg (type 1 diabetes), in het voordeel van de comparator, en ongeveer 0,1 ml / min / mm Hg (type 2 diabetes), in het voordeel van Exubera.
Tijdens de twee jaar durende klinische onderzoeken ervoeren individuele patiënten een opmerkelijke afname van de longfunctie in beide behandelingsgroepen. Een daling ten opzichte van de uitgangswaarde FEV1 van â ‰ ¥ 20% bij de laatste waarneming trad op bij 1,5% van de met Exubera behandelde en 1,3% van de met comparator behandelde patiënten. Een daling ten opzichte van baseline DLCO van â ‰ ¥ 20% bij de laatste waarneming trad op bij 5,1% van de met Exubera behandelde patiënten en bij 3,6% van de met comparator behandelde patiënten.
top
overdosering
Hypoglykemie kan optreden als gevolg van een teveel aan insuline ten opzichte van voedselinname, energieverbruik of beide.
Milde tot matige episoden van hypoglykemie kunnen meestal worden behandeld met orale glucose. Aanpassingen in de dosering van het geneesmiddel, maaltijdpatronen of lichaamsbeweging kunnen nodig zijn.
Ernstige episodes van hypoglykemie met coma, epileptische aanvallen of neurologische stoornissen kunnen worden behandeld met intramusculaire / subcutane glucagon of geconcentreerde intraveneuze glucose. Aanhoudende inname van koolhydraten en observatie kunnen noodzakelijk zijn omdat hypoglykemie kan terugkeren na duidelijk klinisch herstel.
top
Dosering en administratie
Exubera heeft, net als snelwerkende insuline-analogen, een sneller begin van glucoseverlagende activiteit in vergelijking met subcutaan geïnjecteerde normale humane insuline. Exubera heeft een duur van glucoseverlagende activiteit vergelijkbaar met subcutaan geïnjecteerde normale humane insuline en langer dan snelwerkende insuline. Exubera-doses moeten onmiddellijk vóór de maaltijd worden toegediend (niet meer dan 10 minuten vóór elke maaltijd).
Bij patiënten met diabetes type 1 moet Exubera worden gebruikt bij behandelingen met een langer werkende insuline. Voor patiënten met diabetes type 2 kan Exubera worden gebruikt als monotherapie of in combinatie met orale middelen of langer werkende insuline.
Vanwege het effect van Exubera op de longfunctie, moeten alle patiënten de longfunctie laten beoordelen voordat de behandeling met Exubera wordt gestart. Periodieke controle van de longfunctie wordt aanbevolen voor patiënten die worden behandeld met Exubera (zie VOORZORGSMAATREGELEN, Longfunctie).
Exubera is bedoeld voor toediening door inhalatie en mag alleen worden toegediend met behulp van de Exubera® Inhaler. Verwijs naar de Exubera Medicatiehandleiding voor een beschrijving van de Exubera® Inhalator en voor instructies over het gebruik van de inhalator.
Berekening van de initiële dosis voor maaltijdexubera
De initiële dosering van Exubera moet individueel worden bepaald en worden bepaald op basis van het advies van de arts in overeenstemming met de behoeften van de patiënt. Aanbevolen initiële doses voor de maaltijd zijn gebaseerd op klinische onderzoeken waarbij patiënten werden gevraagd om drie maaltijden per dag te eten. De aanvangsdoseringen vóór de maaltijd kunnen worden berekend met behulp van de volgende formule: [Lichaamsgewicht (kg) X 0,05 mg / kg = dosis voor de maaltijd (mg)] naar beneden afgerond op het dichtstbijzijnde hele milligramnummer (bijv. 3,7 mg naar beneden afgerond op 3 mg).
Geschatte richtlijnen voor initiële Exubera-doses voor de maaltijd, gebaseerd op het lichaamsgewicht van de patiënt, zijn aangegeven in tabel 7:
Tabel 7: Geschatte richtlijnen voor initiële dosis vóór maaltijd Exubera (op basis van lichaamsgewicht van de patiënt)
| Gewicht van de patiënt (in kg) |
Gewicht van de patiënt (in lb) |
Initiële dosis per maaltijd | Aantal 1 mg blaren per dosis | Aantal blaren van 3 mg per dosis |
|---|---|---|---|---|
| 30 tot 39,9 kg | 66 - 87 lb | 1 mg per maaltijd | 1 | - |
| 40 tot 59,9 kg | 88 - 132 lb | 2 mg per maaltijd | 2 | - |
| 60 tot 79,9 kg | 133 - 176 lb | 3 mg per maaltijd | - | 1 |
| 80 tot 99,9 kg | 177 - 220 lb | 4 mg per maaltijd | 1 | 1 |
| 100 tot 119,9 kg | 221- 264 lb | 5 mg per maaltijd | 2 | 1 |
| 120 tot 139,9 kg | 265 - 308 lb | 6 mg per maaltijd | - | 2 |
Een blister van 1 mg Exubera geïnhaleerde insuline komt ongeveer overeen met 3 IE subcutaan geïnjecteerde normale humane insuline. Een blister van 3 mg Exubera geïnhaleerde insuline komt ongeveer overeen met 8 IE subcutaan geïnjecteerde normale humane insuline. Tabel 8 geeft de geschatte IE-dosis van normale subcutane humane insuline voor Exubera geïnhaleerde insulinedoses van 1 mg tot 6 mg.
Tabel 8: Geschatte equivalente IE-dosis van normale humane subcutane insuline voor Exubera geïnhaleerde insulinedoses variërend van 1 mg tot 6 mg
| Dosis (mg) | Geschatte normale dosis insuline SC in IE | Aantal 1 mg Exubera-blaren per dosis | Aantal 3 mg Exubera-blaren per dosis |
|---|---|---|---|
| 1 mg | 3 | 1 | - |
| 2 mg | 6 | 2 | - |
| 3 mg | 8 | - | 1 |
| 4 mg | 11 | 1 | 1 |
| 5 mg | 14 | 2 | 1 |
| 6 mg | 16 | - | 2 |
Patiënten moeten 1 mg en 3 mg blisters combineren, zodat het minste aantal blaren per dosis wordt ingenomen (bijv. Een dosis van 4 mg moet worden toegediend als één blister van 1 mg en één blister van 3 mg). Opeenvolgende inhalatie van drie blisters met eenheidsdosis van 1 mg resulteert in een aanzienlijk grotere blootstelling aan insuline dan inhalatie van een blister met eenheidsdosis van 3 mg. Daarom mogen drie doses van 1 mg niet worden vervangen door één dosis van 3 mg (zie KLINISCHE FARMACOLOGIEFarmacokinetiek). Wanneer een patiënt gestabiliseerd is op een doseringsschema dat 3 mg blaren en de 3 mg blaren omvat tijdelijk onbeschikbaar worden, kan de patiënt twee blaren van 1 mg tijdelijk vervangen door één 3 mg blister. Bloedglucose moet nauwlettend worden gecontroleerd.
Zoals bij alle insulines, zijn aanvullende factoren waarmee rekening moet worden gehouden bij het bepalen van de startdosis van Exubera, maar zijn niet beperkt tot, de huidige glykemische controle van de patiënt, eerdere reactie op insuline, duur van diabetes en dieet en lichaamsbeweging gewoonten.
Overwegingen voor dosistitratie
Na het starten van de Exubera-therapie, zoals bij andere glucoseverlagende middelen, kan dosisaanpassing nodig zijn op basis van de behoefte van de patiënt (bijv. bloedglucoseconcentraties, maaltijdgrootte en voedingsstofsamenstelling, tijdstip van de dag en recent of verwacht oefening). Elke patiënt moet worden getitreerd tot zijn optimale dosering op basis van bloedglucose monitoringresultaten.
Zoals voor alle insulines, kan het tijdsverloop van Exubera-actie variëren bij verschillende personen of op verschillende tijdstippen bij dezelfde persoon.
Exubera kan worden gebruikt tijdens bijkomende aandoeningen van de luchtwegen (bijvoorbeeld bronchitis, infectie van de bovenste luchtwegen, rhinitis). Nauwgezette monitoring van bloedglucoseconcentraties en dosisaanpassing kan op individuele basis nodig zijn. Geïnhaleerde geneesmiddelen (bijv. Bronchusverwijders) moeten voorafgaand aan toediening van Exubera worden toegediend.
top
Hoe geleverd
Exubera (humane insuline [oorsprong van rDNA]) Inademingspoeder is verkrijgbaar in blisters van 1 mg en 3 mg. De blisters worden uitgegeven op geperforeerde kaarten van zes blisters met eenheidsdosis (PVC / aluminium). De twee sterke punten worden onderscheiden door kleurenprint en voelbare markeringen die kunnen worden onderscheiden door aanraking. De blisters van 1 mg en de respectievelijke geperforeerde kaarten zijn bedrukt met groene inkt en de kaarten zijn gemarkeerd met een verhoogde balk. De blisters van 3 mg en de respectievelijke geperforeerde kaarten zijn bedrukt met blauwe inkt en de kaarten zijn gemarkeerd met drie verhoogde balken.
Vijf blisterkaarten zijn verpakt in een doorzichtige plastic (PET) thermogevormde lade. Elke PET-schaal bevat ook een droogmiddel en is bedekt met een doorzichtig plastic (PET) deksel. De lade met vijf blisterkaarten (30 eenheidsdosisblisterverpakkingen) is verzegeld in een folie-laminaatzak met een droogmiddel.
Exubera (humane insuline [oorsprong van rDNA]) Blaren voor inhalatiepoeder, een Exubera® Inhalator en vervangende Exubera® Vrijgave-eenheden zijn vereist om therapie met Exubera te starten en worden geleverd in de Exubera-kit. Een volledig geassembleerde Exubera® Inhalator bestaat uit de inhalatorbasis, een kamer en een Exubera® Eenheid vrijgeven. Een volledig geassembleerde inhalator is verpakt met een vervangende kamer en is verkrijgbaar in de Exubera-set en als een afzonderlijke eenheid. De kamer is ook beschikbaar als een afzonderlijke component.
Exubera® Release Units zijn individueel verpakt in een verzegelde thermovormbak. Eén Exubera® De release-eenheid is inbegrepen in elke volledig geassembleerde inhalator. Twee extra release-eenheden worden geleverd in de Exubera-kit en in elk combinatiepakket. Exubera-release-eenheden zijn ook afzonderlijk verkrijgbaar.
Zie tabellen 9 en 10 voor een beschrijving van deze configuraties.
Tabel 9
| Exubera (humane insuline [oorsprong van rDNA]) Inhalatiepoeder is als volgt verkrijgbaar: | ||
|---|---|---|
| Beschrijving | Inhoud | NDC |
| Exubera KIT | 1 Exubera-inhalator 1 Vervangingskamer 1 mg à 180 blaren 3 mg × 90 blaren 2 Exubera® Eenheden vrijgeven |
0069-0050-85 |
| Exubera-combinatiepakket 12 | 1 mg × 90 blaren 3 mg × 90 blaren 2 Exubera® Eenheden vrijgeven |
0069-0050-19 |
| Exubera-combinatiepakket 15 | 1 mg à 180 blaren 3 mg × 90 blaren 2 Exubera® Eenheden vrijgeven |
0069-0050-53 |
| Exubera 1 mg patiëntenverpakking | 90 - 1 mg 2 Exubera® Eenheden vrijgeven |
0069-0707-37 |
| Exubera 3 mg patiëntenverpakking | 90 - 3 mg 2 Exubera® Eenheden vrijgeven |
0069-0724-37 |
Tabel 10
| Exubera® Inhalator en componenten zijn als volgt beschikbaar: | ||
|---|---|---|
| Beschrijving | Inhoud | NDC |
| Exubera® Inhalator & kamer | 1 Exubera® inhalatietoestel 1 Vervangingskamer |
0069-0054-19 |
| Exubera® Eenheden vrijgeven | 2 Exubera® Eenheden vrijgeven | 0069-0097-41 |
| Exubera® Kamer | 1 Vervangingskamer | 0069-0061-19 |
Blister opslag
Niet in gebruik (ongeopend): Bewaren bij een gecontroleerde kamertemperatuur, 25 ° C (77 ° F); excursies toegestaan tot 15-30 ° C (59-86 ° F) [zie USP Gecontroleerde kamertemperatuur]. Niet bevriezen. Niet in de koelkast bewaren.
In gebruik: Zodra de folieverpakking is geopend, moeten blisterverpakkingen met eenheidsdosis worden beschermd tegen vocht, bewaard bij 25 ° C (77 ° F); excursies toegestaan tot 15-30 ° C (59-86 ° F) [zie USP Gecontroleerde kamertemperatuur]. Niet bevriezen. Niet in de koelkast bewaren. Eenheidsblisterverpakkingen moeten binnen 3 maanden na opening van de folieverpakking worden gebruikt. Plaats de blaren terug in de buitenverpakking om tegen vocht te beschermen. Extra aandacht moet worden besteed aan het vermijden van vochtige omgevingen, b.v. stomende badkamer na een douche.
Gooi de blister weg als deze bevroren is.
Inhalatoropslag
Bewaren bij gecontroleerde kamertemperatuur, 25 ° C (77 ° F); excursies toegestaan tot 15-30 ° C (59-86 ° F) [zie USP Gecontroleerde kamertemperatuur]. Niet bevriezen. Niet in de koelkast bewaren.
De Exubera® Inhalator kan worden gebruikt tot 1 jaar na de datum van eerste gebruik.
De Exubera vervangen® Eenheid vrijgeven
De Exubera® Maak de eenheid vrij in de Exubera® De inhalator moet om de 2 weken worden vervangen.
Buiten bereik van kinderen houden
Alleen Rx

LAB-0.331-12,0
laatste revisie 04/2008
Exubera, insuline humaan [rDNA-oorsprong] Patiëntinformatie (In gewoon Engels)
Gedetailleerde informatie over tekenen, symptomen, oorzaken, behandelingen van diabetes
De informatie in deze monografie is niet bedoeld om alle mogelijke toepassingen, aanwijzingen, voorzorgsmaatregelen, interacties tussen geneesmiddelen of bijwerkingen te dekken. Deze informatie is algemeen en is niet bedoeld als specifiek medisch advies. Neem contact op met uw arts, apotheker of verpleegkundige als u vragen heeft over de medicijnen die u gebruikt of meer informatie wenst.
terug naar: Blader door alle medicijnen voor diabetes



