Apidra voor de behandeling van diabetes
Merknaam: Apidra
Generieke naam: Insuline Glulisine
Apidra (insuline glulisine) is een door de mens gemaakt product dat vrijwel identiek is aan humane insuline. Het wordt gebruikt om diabetes mellitus te behandelen. Gebruik, dosering, bijwerkingen.
Inhoud:
Aanwijzingen en gebruik
Dosering en administratie
Contra
Waarschuwingen en voorzorgsmaatregelen
Bijwerkingen
Geneesmiddelinteracties
Gebruik in specifieke populaties
overdosering
Beschrijving
Klinische Farmacologie
Niet-klinische Toxicologie
Klinische studies
Hoe geleverd
Apidra, insuline glusine, patiëntinformatie (In gewoon Engels)
indicaties
Apidra is een snelwerkende humane insuline-analoog die wordt geïndiceerd om de glykemische controle bij volwassenen en kinderen met diabetes mellitus te verbeteren.
top
Dosering en administratie
Dosering overwegingen
APIDRA is een recombinant insuline-analoog dat even krachtig is als humane insuline (d.w.z. één eenheid APIDRA heeft hetzelfde glucoseverlagende effect als één eenheid gewone humane insuline) wanneer intraveneus toegediend. Bij subcutane toediening heeft APIDRA een snellere werking en een kortere werkingsduur dan gewone humane insuline.
De dosering van APIDRA moet individueel worden bepaald. Bloedglucosebewaking is essentieel bij alle patiënten die met insuline worden behandeld.
De totale dagelijkse insulinebehoefte kan variëren en ligt meestal tussen 0,5 en 1 eenheid / kg / dag. De insulinebehoefte kan worden gewijzigd tijdens stress, ernstige ziekte of bij veranderingen in lichaamsbeweging, maaltijdpatronen of gelijktijdig toegediende geneesmiddelen.
Subcutane toediening
APIDRA moet binnen 15 minuten vóór een maaltijd worden gegeven of binnen 20 minuten na het starten van een maaltijd.
APIDRA toegediend via subcutane injectie moet in het algemeen worden gebruikt bij behandelingen met een intermediaire of langwerkende insuline.
APIDRA moet worden toegediend door subcutane injectie in de buikwand, dij of bovenarm. De injectieplaatsen moeten binnen dezelfde regio (buik, dij of bovenarm) van de ene injectie naar de andere worden gedraaid om het risico op lipodystrofie te verminderen [Zie BIJWERKINGEN].
Continue subcutane infusie (insulinepomp)
APIDRA kan worden toegediend door middel van continue subcutane infusie in de buikwand. Gebruik geen verdunde of gemengde insulines in externe insulinepompen. Infusieplaatsen moeten binnen dezelfde regio worden gedraaid om het risico op lipodystrofie te verminderen [Zie BIJWERKINGEN]. De initiële programmering van de externe insuline-infusiepomp moet gebaseerd zijn op de totale dagelijkse insulinedosis van het vorige regime.
De volgende insulinepompen zijn gebruikt in APIDRA klinische onderzoeken uitgevoerd door sanofi-aventis, de fabrikant van APIDRA:
- Disetronic® H-Tron® plus V100 en D-Tron® met Disetronic-katheters (Rapid ™, Rapid C ™, Rapid D ™ en Tender ™)
- MiniMed®-modellen 506, 507, 507c en 508 met MiniMed-katheters (Sof-set Ultimate QR ™ en Quick-set ™).
Voordat u een andere insulinepomp met APIDRA gebruikt, moet u het etiket van de pomp lezen om te controleren of de pomp is geëvalueerd met APIDRA.
Artsen en patiënten moeten de informatie over het pompgebruik zorgvuldig evalueren in de voorschriftinformatie van APIDRA, de bijsluiter voor de patiënt en de handleiding van de pompfabrikant. APIDRA-specifieke informatie moet worden gevolgd voor de gebruikstijd, de frequentie van het veranderen van infusiesets of andere details specifiek voor het gebruik van APIDRA, omdat APIDRA-specifieke informatie kan verschillen van de algemene pomphandleiding instructies.
Op basis van in-vitrostudies die verlies van het conserveermiddel, metacresol en insulineafbraak hebben aangetoond, moet APIDRA in het reservoir ten minste om de 48 uur worden vervangen. APIDRA bij klinisch gebruik mag niet worden blootgesteld aan temperaturen hoger dan 37 ° C (98,6 ° F). [Zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en HOE GELEVERD / Opslag en behandeling].
Intraveneuze toediening
APIDRA kan intraveneus worden toegediend onder medisch toezicht voor glykemische controle met nauwkeurige monitoring van bloedglucose en serumkalium om hypoglykemie en hypokaliëmie te voorkomen. Voor intraveneus gebruik moet APIDRA worden gebruikt in concentraties van 0,05 Eenheden / ml tot 1 Eenheid / ml insuline glulisine in infusiesystemen met polyvinylchloride (PVC) -zakken. APIDRA is alleen stabiel gebleken in normale zoutoplossing (0,9% natriumchloride). Parenterale geneesmiddelen moeten vóór toediening visueel worden geïnspecteerd op deeltjes en verkleuring, wanneer de oplossing en de verpakking dit toelaten. Dien insuline-mengsels niet intraveneus toe.
Doseringsvormen en sterktes
Apidra 100 eenheden per ml (U-100) is beschikbaar als:
- 10 ml flesjes
- 3 ml cartridges voor gebruik in de OptiClik® Insulinetoedieningsapparaat
- 3 ml SoloStar voorgevulde pen
top
Contra
Apidra is gecontra-indiceerd:
- tijdens afleveringen van hypoglykemie
- bij patiënten die overgevoelig zijn voor Apidra of voor één van de hulpstoffen
Bij gebruik bij patiënten met bekende overgevoeligheid voor Apidra of zijn hulpstoffen, kunnen patiënten gelokaliseerde of gegeneraliseerde overgevoeligheidsreacties ontwikkelen [zie Bijwerkingen].
top
Waarschuwingen en voorzorgsmaatregelen
Aanpassing en monitoring van de dosering
Glucosebewaking is essentieel voor patiënten die met insuline worden behandeld. Wijzigingen in een insulineregime moeten voorzichtig worden aangebracht en alleen onder medisch toezicht. Veranderingen in insuline sterkte, fabrikant, type of wijze van toediening kunnen ertoe leiden dat een wijziging van de insulinedosis nodig is. Gelijktijdige orale behandeling met antidiabetica moet mogelijk worden aangepast.
Zoals met alle insulinepreparaten, kan het tijdsverloop van actie voor Apidra variëren in verschillende personen of op verschillende tijdstippen in dezelfde persoon en is afhankelijk van vele aandoeningen, waaronder de injectieplaats, lokale bloedtoevoer of lokaal temperatuur. Patiënten die hun niveau van lichamelijke activiteit of maaltijdplan wijzigen, kunnen aanpassing van de insulinedosering nodig hebben.
hypoglykemie
Hypoglykemie is de meest voorkomende bijwerking van insulinetherapie, inclusief Apidra. Het risico op hypoglykemie neemt toe met een nauwere glykemische controle. Patiënten moeten worden opgeleid om hypoglykemie te herkennen en te beheersen. Ernstige hypoglykemie kan leiden tot bewusteloosheid en / of convulsies en kan leiden tot tijdelijke of permanente verslechtering van de hersenfunctie of de dood. Ernstige hypoglykemie die de hulp van een andere persoon en / of parenterale glucose-infusie vereist of glucagon toediening is waargenomen in klinische onderzoeken met insuline, inclusief onderzoeken met Apidra.
De timing van hypoglykemie weerspiegelt meestal het tijd-actieprofiel van de toegediende insulinesamenstellingen. Andere factoren zoals veranderingen in voedselinname (bijv. Hoeveelheid voedsel of timing van maaltijden), injectieplaats, lichaamsbeweging en gelijktijdig toegediende medicijnen kunnen ook het risico op hypoglykemie veranderen [Zie Geneesmiddelinteracties].
Zoals met alle insulines, wees voorzichtig bij patiënten met onbewustheid van hypoglykemie en bij mogelijke patiënten aanleg voor hypoglykemie (bijvoorbeeld de pediatrische populatie en patiënten die vasten of grillig voedsel hebben intake). Het concentratie- en reactievermogen van de patiënt kan verminderd zijn bij hypoglykemie. Dit kan een risico vormen in situaties waarin deze vaardigheden bijzonder belangrijk zijn, zoals autorijden of het bedienen van andere machines.
Snelle veranderingen in serumglucosespiegels kunnen symptomen veroorzaken die vergelijkbaar zijn met hypoglykemie bij personen met diabetes, ongeacht de glucosewaarde. Vroege waarschuwingssymptomen van hypoglykemie kunnen onder bepaalde omstandigheden anders of minder uitgesproken zijn, zoals langdurige diabetes, diabetische zenuwziekte, gebruik van medicijnen zoals bètablokkers [Zie Geneesmiddelinteracties] of verhoogde diabetescontrole. Deze situaties kunnen leiden tot ernstige hypoglykemie (en mogelijk bewustzijnsverlies) voordat de patiënt zich bewust wordt van hypoglykemie.
Intraveneus toegediende insuline heeft een sneller begin van werking dan subcutaan toegediende insuline, waardoor nauwlettende controle op hypoglykemie nodig is.
Overgevoeligheid en allergische reacties
Ernstige, levensbedreigende, gegeneraliseerde allergie, inclusief anafylaxie, kan optreden met insulineproducten, waaronder Apidra [Zie Bijwerkingen].
hypokaliëmie
Alle insulineproducten, inclusief Apidra, veroorzaken een verschuiving van kalium van de extracellulaire naar intracellulaire ruimte, wat mogelijk tot hypokaliëmie leidt. Onbehandelde hypokaliëmie kan ademhalingsverlamming, ventriculaire aritmie en de dood veroorzaken. Wees voorzichtig bij patiënten die mogelijk een risico lopen op hypokaliëmie (bijvoorbeeld patiënten die kaliumverlagende medicijnen gebruiken, patiënten die medicijnen gebruiken die gevoelig zijn voor serumkaliumconcentraties). Controleer glucose en kalium regelmatig wanneer Apidra intraveneus wordt toegediend.
Nier- of leverinsufficiëntie
Frequente glucosemonitoring en insulinedosisverlaging kan nodig zijn bij patiënten met nier- of leverinsufficiëntie [zie Klinische Farmacologie].
Mengen van insulines
Apidra voor subcutane injectie mag niet worden gemengd met andere insulinepreparaten dan NPH-insuline. Als Apidra wordt gemengd met NPH-insuline, moet Apidra eerst in de spuit worden getrokken. Injectie moet onmiddellijk na het mengen plaatsvinden.
Meng Apidra niet met andere insulines voor intraveneuze toediening of voor gebruik in een continue subcutane infusiepomp.
Apidra voor intraveneuze toediening mag niet worden verdund met oplossingen anders dan 0,9% natriumchloride (normale zoutoplossing). De werkzaamheid en veiligheid van het mengen van Apidra met verdunningsmiddelen of andere insulines voor gebruik in externe subcutane infusiepompen zijn niet vastgesteld.
Subcutane insuline-infuuspompen
Bij gebruik in een externe insulinepomp voor subcutane infusie mag Apidra niet worden verdund of gemengd met andere insuline. Apidra in het reservoir moet ten minste om de 48 uur worden vervangen. Apidra mag niet worden blootgesteld aan temperaturen hoger dan 37 ° C (98,6 ° F).
Defecten van de insulinepomp of infusieset of insulinedegradatie kunnen snel leiden tot hyperglycemie en ketose. Snelle identificatie en correctie van de oorzaak van hyperglykemie of ketose is noodzakelijk. Tussentijdse subcutane injecties met Apidra kunnen nodig zijn. Patiënten die continue subcutane insuline-infusiepomptherapie gebruiken, moeten worden getraind om insuline door injectie toe te dienen en moeten alternatieve insulinetherapie beschikbaar hebben in geval van pompstoring. [Zien Dosering en administratie, Hoe geleverd / opslag en gebruik].
Intraveneuze toediening
Wanneer Apidra intraveneus wordt toegediend, moeten glucose- en kaliumspiegels nauwlettend worden gecontroleerd om mogelijk fatale hypoglykemie en hypokaliëmie te voorkomen.
Meng Apidra niet met andere insulines voor intraveneuze toediening. Apidra mag alleen worden verdund in een normale zoutoplossing.
Geneesmiddelinteracties
Sommige medicijnen kunnen de insulinebehoefte en het risico op hypoglykemie of hyperglykemie veranderen [Zie Geneesmiddelinteracties].
top
Bijwerkingen
De volgende bijwerkingen worden elders besproken:
- Hypoglykemie [Zie Waarschuwingen en voorzorgsmaatregelen]
- Hypokalemia [Zie Waarschuwingen en voorzorgsmaatregelen]
Klinische proefervaring
Omdat klinische onderzoeken onder sterk uiteenlopende ontwerpen worden uitgevoerd, is het mogelijk dat de bijwerkingen die in één klinisch onderzoek zijn gerapporteerd, dat niet zijn gemakkelijk vergeleken kunnen worden met de percentages die gerapporteerd zijn in een andere klinische proef, en is mogelijk geen afspiegeling van de percentages die daadwerkelijk werden waargenomen in klinische studies praktijk.
De frequenties van bijwerkingen tijdens klinische onderzoeken met Apidra bij patiënten met diabetes mellitus type 1 en diabetes mellitus type 2 staan vermeld in de onderstaande tabellen.
Tabel 1: Behandeling -mergente bijwerkingen in gepoolde studies bij volwassenen met type 1 diabetes (bijwerkingen met frequentie â ‰ ¥ 5%)
| APIDRA,% (N = 950) |
Alle vergelijkerseen, % (N = 641) |
|
| nasofaryngitis | 10.6 | 12.9 |
| hypoglykemieb | 6.8 | 6.7 |
| Bovenste luchtweginfectie | 6.6 | 5.6 |
| Influenza | 4.0 | 5.0 |
|
een Insuline lispro, normale humane insuline, insuline aspart b Alleen ernstige symptomatische hypoglykemie |
Tabel 2: Behandeling -mergente bijwerkingen in gepoolde studies bij volwassenen met diabetes type 2 (bijwerkingen met frequentie â ‰ ¥ 5%)
| APIDRA,% (N = 883) |
Regelmatige humane insuline,% (N = 883) |
|
| Bovenste luchtweginfectie | 10.5 | 7.7 |
| nasofaryngitis | 7.6 | 8.2 |
| Perifeer oedeem | 7.5 | 7.8 |
| Influenza | 6.2 | 4.2 |
| arthralgie | 5.9 | 6.3 |
| hypertensie | 3.9 | 5. |
- Kindergeneeskunde
Tabel 3 vat de bijwerkingen samen die voorkomen met een frequentie hoger dan 5% in een klinisch onderzoek bij kinderen en adolescenten met type 1 diabetes behandeld met APIDRA (n = 277) of insuline lispro (N = 295).
Tabel 3: Behandeling - Bijwerkingen bij kinderen en adolescenten met diabetes type 1 (bijwerkingen met frequentie â â ¥ 5%)
| APIDRA,% (N = 277) |
Lispro,% (N = 295) |
|
| nasofaryngitis | 9.0 | 9.5 |
| Bovenste luchtweginfectie | 8.3 | 10.8 |
| Hoofdpijn | 6.9 | 11.2 |
| Hypoglycemische aanval | 6.1 | 4.7 |
- Ernstige symptomatische hypoglykemie
Hypoglykemie is de meest waargenomen bijwerking bij patiënten die insuline gebruiken, waaronder Apidra [zie Waarschuwingen en voorzorgsmaatregelen]. De percentages en incidentie van ernstige symptomatische hypoglykemie, gedefinieerd als hypoglykemie waarvoor interventie van een derde nodig was, waren vergelijkbaar voor alle behandelingsregimes (zie tabel 4). In de fase 3 klinische studie hadden kinderen en adolescenten met type 1 diabetes een hogere incidentie van ernstige symptomatische hypoglykemie in de twee behandelingsgroepen in vergelijking met volwassenen met type 1 diabetes. (zie tabel 4) [Zie Klinische studies].
Tabel 4: Ernstige symptomatische hypoglykemie *
| Type 1 diabetes volwassenen 12 weken met insuline glargine |
Type 1 diabetes volwassenen 26 weken met insuline glargine |
Type 2 diabetes volwassenen 26 weken met NPH humane insuline |
Type 1 Diabetes Kindergeneeskunde 26 weken |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Apidra Pre-maaltijd |
Apidra Post-maaltijd |
Regelmatige menselijke insuline | Apidra | Insuline Lispro | Apidra | Regelmatige menselijke insuline | Apidra | Insuline Lispr | |
| * Ernstige symptomatische hypoglykemie gedefinieerd als een hypoglycemische gebeurtenis die de hulp van een andere persoon vereist die aan een van de volgende criteria voldoet: de gebeurtenis werd geassocieerd met een bloedglucose waarnaar wordt verwezen <36 mg / dL of de gebeurtenis werd geassocieerd met snel herstel na orale toediening van koolhydraten, intraveneuze glucose of glucagon. | |||||||||
| Evenementen per maand per patiënt | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Percentage patiënten (n / totaal N) | 8.4% (24/286) | 8.4% (25/296) | 10.1% (28/278) | 4.8% (16/339) |
4.0% (13/333) |
1.4% (6/416) |
1.2% (5/420) |
16.2% (45/277) |
19.3% (57/295) |
- Insuline-initiatie en intensivering van glucosecontrole
Intensivering of snelle verbetering van glucosecontrole is geassocieerd met een voorbijgaande, omkeerbare oogheelkundige refractiestoornis, verergering van diabetische retinopathie en acute pijnlijke perifere neuropathie. Langdurige glycemische controle vermindert echter het risico op diabetische retinopathie en neuropathie.
- lipodystrofie
Langdurig gebruik van insuline, inclusief Apidra, kan lipodystrofie veroorzaken op de plaats van herhaalde insuline-injecties of infusie. Lipodystrofie omvat lipohypertrofie (verdikking van vetweefsel) en lipoatrofie (verdunning van vetweefsel) en kan de absorptie van insuline beïnvloeden. Roteer insuline-injectie of infusieplaatsen in dezelfde regio om het risico op lipodystrofie te verminderen. [Zien Dosering en administratie].
- Gewichtstoename
Gewichtstoename kan optreden bij insulinetherapie, waaronder Apidra, en is toegeschreven aan de anabole effecten van insuline en de afname van glucosurie.
- Perifeer oedeem
Insuline, inclusief Apidra, kan natriumretentie en oedeem veroorzaken, vooral als eerder slechte metabole controle wordt verbeterd door intensievere insulinetherapie.
- Bijwerkingen met continue subcutane insuline-infusie (CSII)
In een 12 weken durende gerandomiseerde studie bij patiënten met type 1 diabetes (n = 59), de tarieven van de katheter occlusies en reacties op de infusieplaats waren vergelijkbaar voor met Apidra en met insuline aspart behandelde patiënten (Tabel 5).
Tabel 5: occlusies van katheters en reacties op de infusieplaats.
| Apidra (N = 29) |
insuline aspart (N = 30) |
|
|---|---|---|
| Katheterocclusies / maand | 0.08 | 0.15 |
| Reacties op de infusieplaats | 10.3% (3/29) | 13.3% (4/30) |
- Allergische reacties
Lokale allergie
Zoals bij elke insulinetherapie kunnen patiënten die Apidra gebruiken roodheid, zwelling of jeuk op de injectieplaats ervaren. Deze minder belangrijke reacties verdwijnen meestal binnen een paar dagen tot een paar weken, maar in sommige gevallen kan stopzetting van Apidra nodig zijn. In sommige gevallen kunnen deze reacties verband houden met andere factoren dan insuline, zoals irriterende stoffen in een huidreinigingsmiddel of een slechte injectietechniek.
Systemische allergie
Ernstige, levensbedreigende, gegeneraliseerde allergie, inclusief anafylaxie, kan voorkomen bij elke insuline, inclusief Apidra. Gegeneraliseerde allergie voor insuline kan uitslag op het hele lichaam (inclusief jeuk), dyspneu, piepende ademhaling, hypotensie, tachycardie of diaforese veroorzaken.
In gecontroleerde klinische onderzoeken met een duur tot 12 maanden, werden in 79 van 19 mogelijke systemische allergische reacties gemeld 1833 patiënten (4,3%) die Apidra kregen en 58 van de 1524 patiënten (3,8%) die de comparator kortwerkend ontvingen insulines. Tijdens deze onderzoeken werd de behandeling met Apidra bij 1 van de 1833 patiënten permanent gestaakt vanwege een mogelijke systemische allergische reactie.
Gelokaliseerde reacties en gegeneraliseerde myalgie zijn gemeld bij het gebruik van metacresol, een hulpstof van Apidra.
Productie van antilichamen
In een onderzoek bij patiënten met type 1 diabetes (n = 333), de concentraties van insuline-antilichamen die reageren met zowel humane insuline als insuline glulisine (kruisreactieve insuline-antilichamen) bleef tijdens de eerste 6 maanden van de studie bij de patiënten die werden behandeld met Apidra. Een afname van de antilichaamconcentratie werd waargenomen tijdens de volgende 6 maanden van het onderzoek. In een onderzoek bij patiënten met type 2 diabetes (n = 411) was een vergelijkbare toename van de concentratie van kruisreactieve insuline-antilichamen waargenomen bij de patiënten behandeld met Apidra en bij de patiënten behandeld met humane insuline gedurende de eerste 9 maanden van de studie. Daarna daalde de concentratie antilichamen bij de Apidra-patiënten en bleef stabiel bij de humane insuline-patiënten. Er was geen verband tussen de concentratie van kruisreactieve insuline-antilichamen en veranderingen in HbA1c, insulinedoses of de incidentie van hypoglykemie. De klinische betekenis van deze antilichamen is niet bekend.
Apidra wekte geen significante antilichaamrespons op in een onderzoek bij kinderen en adolescenten met type 1 diabetes.
Postmarketing ervaring
De volgende bijwerkingen zijn geïdentificeerd tijdens het gebruik van Apidra na goedkeuring.
Omdat deze reacties vrijwillig worden gemeld door een populatie van onzekere omvang, is dat niet het geval altijd mogelijk om hun frequentie betrouwbaar te schatten of een oorzakelijk verband met het geneesmiddel vast te stellen blootstelling.
Medicatiefouten zijn gemeld waarbij andere insulines, met name langwerkende insulines, per ongeluk zijn toegediend in plaats van Apidra.
top
Geneesmiddelinteracties
Een aantal geneesmiddelen beïnvloedt het glucosemetabolisme en kan aanpassing van de insulinedosis en in het bijzonder nauwkeurige monitoring noodzakelijk maken.
Geneesmiddelen die het bloedglucoseverlagende effect van insulines, waaronder Apidra, kunnen verhogen en daarom het risico op hypoglykemie verhogen, omvatten orale antidiabetica, pramlintide, ACE-remmers, disopyramide, fibraten, fluoxetine, monoamine-oxidaseremmers, propoxyfeen, pentoxifylline, salicylaten, somatostatine-analogen en sulfonamide antibiotica.
Geneesmiddelen die het bloedglucoseverlagende effect van Apidra kunnen verminderen, zijn onder andere corticosteroïden, niacine, danazol, diuretica, sympathicomimetica (bijv. Epinefrine, albuterol, terbutaline), glucagon, isoniazide, fenothiazinederivaten, somatropine, schildklierhormonen, oestrogenen, progestagenen (bijv. in orale anticonceptiva), proteaseremmers en atypisch antipsychotica.
Bètablokkers, clonidine, lithiumzouten en alcohol kunnen het bloedglucoseverlagende effect van insuline verhogen of verlagen.
Pentamidine kan hypoglykemie veroorzaken, wat soms kan worden gevolgd door hyperglykemie.
De symptomen van hypoglykemie kunnen verminderd of afwezig zijn bij patiënten die anti-adrenerge geneesmiddelen gebruiken, zoals bètablokkers, clonidine, guanethidine en reserpine.
top
Gebruik in specifieke populaties
Zwangerschap
Zwangerschap Categorie C: er zijn reproductie- en teratologiestudies uitgevoerd met insuline glulisine bij ratten en konijnen met gewone humane insuline als vergelijkingsmiddel. Insuline glulisine werd tijdens de zwangerschap aan vrouwelijke ratten gegeven met subcutane doses tot 10 eenheden / kg eenmaal daags (dosis resulterend in een blootstelling twee keer de gemiddelde dosis voor mensen, gebaseerd op vergelijking van lichaamsoppervlak) en had geen opmerkelijke toxische effecten op embryo-foetus ontwikkeling.
Insuline glulisine werd tijdens de zwangerschap aan vrouwelijke konijnen gegeven in subcutane doses tot 1,5 Eenheden / kg / dag (dosis resulterend in een blootstelling 0,5 maal de gemiddelde dosis voor mensen, gebaseerd op lichaamsoppervlak vergelijking). Bijwerkingen op de embryo-foetale ontwikkeling werden alleen waargenomen bij toxische doses voor de moeder die hypoglykemie induceren. Verhoogde incidentie van post-implantatieverliezen en skeletafwijkingen werden waargenomen bij een dosisniveau van 1,5 eenheden / kg eenmaal daags (dosis resulterend in een blootstelling 0,5 maal de gemiddelde dosis voor mensen, gebaseerd op vergelijking van het lichaamsoppervlak) die ook mortaliteit veroorzaakte in dammen. Een licht verhoogde incidentie van post-implantatieverliezen werd gezien bij het volgende lagere dosisniveau van 0,5 eenheden / kg eenmaal daags (dosis resulterend in een blootstelling 0,2 maal de gemiddelde dosis voor mensen, gebaseerd op vergelijking van het lichaamsoppervlak) die ook in verband werd gebracht met ernstige hypoglykemie maar daar waren geen defecten dosis. Er werden geen effecten waargenomen bij konijnen bij een dosis van 0,25 eenheden / kg eenmaal daags (dosis resulterend in een blootstelling 0,1 maal de gemiddelde dosis voor mensen, gebaseerd op vergelijking van het lichaamsoppervlak). De effecten van insuline glulisine verschilden niet van die waargenomen met subcutane normale humane insuline in dezelfde doses en werden toegeschreven aan secundaire effecten van hypoglykemie bij de moeder.
Er zijn geen goed gecontroleerde klinische onderzoeken naar het gebruik van Apidra bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de reactie van de mens, dient dit medicijn alleen tijdens de zwangerschap te worden gebruikt als het potentiële voordeel het potentiële risico voor de foetus rechtvaardigt. Het is essentieel voor patiënten met diabetes of een geschiedenis van zwangerschapsdiabetes om een goede metabole controle te behouden vóór de conceptie en tijdens de zwangerschap. De insulinebehoefte kan tijdens het eerste trimester afnemen, in het algemeen tijdens het tweede en derde trimester toenemen en na aflevering snel afnemen. Zorgvuldige monitoring van glucosecontrole is essentieel bij deze patiënten.
Moeders die borstvoeding geven
Het is onbekend of insuline glulisine wordt uitgescheiden in moedermelk. Omdat veel geneesmiddelen in moedermelk worden uitgescheiden, is voorzichtigheid geboden wanneer Apidra wordt toegediend aan een vrouw die borstvoeding geeft. Het gebruik van Apidra is compatibel met borstvoeding, maar vrouwen met diabetes die borstvoeding geven, kunnen aanpassingen van hun insulinedosis nodig hebben.
Gebruik bij kinderen
De veiligheid en effectiviteit van subcutane injecties van Apidra zijn vastgesteld bij pediatrische patiënten (leeftijd 4 tot 17 jaar) met type 1 diabetes [Zie Klinische studies]. Apidra is niet onderzocht bij pediatrische patiënten met type 1 diabetes jonger dan 4 jaar en bij pediatrische patiënten met type 2 diabetes.
Net als bij volwassenen moet de dosering van Apidra bij pediatrische patiënten worden aangepast op basis van metabole behoeften en frequente controle van bloedglucose.
Geriatrisch gebruik
In klinische onderzoeken (n = 2408) werd Apidra toegediend aan 147 patiënten â ¥ 65 jaar oud en 27 patiënten â ¥ 75 jaar oud. De meerderheid van deze kleine subset van oudere patiënten had diabetes type 2. De verandering in HbA1c-waarden en hypoglykemiefrequenties verschilde niet naar leeftijd. Niettemin is voorzichtigheid geboden wanneer Apidra wordt toegediend aan geriatrische patiënten.
top
overdosering
Overmatige insuline kan hypoglykemie veroorzaken en, vooral bij intraveneuze toediening, hypokaliëmie. Milde episodes van hypoglykemie kunnen meestal worden behandeld met orale glucose. Aanpassingen in de dosering van het geneesmiddel, maaltijdpatronen of lichaamsbeweging kunnen nodig zijn. Meer ernstige episodes van hypoglykemie met coma, epileptische aanvallen of neurologische stoornissen kunnen worden behandeld met intramusculaire / subcutane glucagon of geconcentreerde intraveneuze glucose. Aanhoudende inname van koolhydraten en observatie kunnen noodzakelijk zijn omdat hypoglykemie kan terugkeren na duidelijk klinisch herstel. Hypokaliëmie moet correct worden gecorrigeerd.
Beschrijving
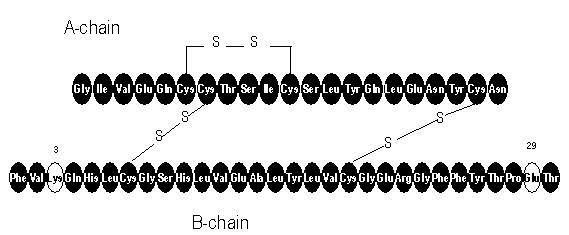
Apidra® (insuline glulisine [rDNA oorsprong] injectie) is een snelwerkende humane insuline-analoog die wordt gebruikt om de bloedglucose te verlagen. Insuline glulisine wordt geproduceerd door recombinant-DNA-technologie met behulp van een niet-pathogene laboratoriumstam van Escherichia coli (K12). Insuline glulisine verschilt van humane insuline doordat het aminozuur asparagine op positie B3 wordt vervangen door lysine en het lysine op positie B29 wordt vervangen door glutaminezuur. Chemisch gezien is insuline glulisine 3B-lysine-29B-glutaminezuur-humane insuline, heeft de empirische formule C258H384N64O78S6 en heeft een molecuulgewicht van 5823 en heeft de volgende structuurformule:
Apidra is een steriele, waterige, heldere en kleurloze oplossing. Elke milliliter Apidra bevat 100 eenheden (3,49 mg) insuline glulisine, 3,15 mg metacresol, 6 mg tromethamine, 5 mg natriumchloride, 0,01 mg polysorbaat 20 en water voor injectie. Apidra heeft een pH van ongeveer 7,3. De pH wordt ingesteld door toevoeging van waterige oplossingen van zoutzuur en / of natriumhydroxide.
top
Klinische Farmacologie
Werkingsmechanisme
Regulatie van glucosemetabolisme is de primaire activiteit van insulines en insuline-analogen, waaronder insuline glulisine. Insulines verlagen de bloedglucose door de opname van perifere glucose door skeletspieren en vet te stimuleren en door de productie van hepatische glucose te remmen. Insulines remmen lipolyse en proteolyse en verbeteren de eiwitsynthese.
De glucoseverlagende activiteiten van Apidra en van reguliere humane insuline zijn equipotent bij toediening via de intraveneuze route. Na subcutane toediening is het effect van Apidra sneller en van kortere duur in vergelijking met gewone humane insuline. [Zie Farmacodynamiek].
farmacodynamiek
Studies bij gezonde vrijwilligers en patiënten met diabetes hebben aangetoond dat Apidra sneller werkt begin van actie en een kortere activiteitsduur dan normale humane insuline wanneer gegeven subcutaan.
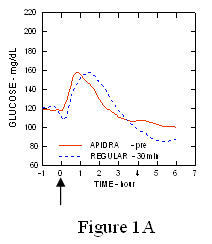
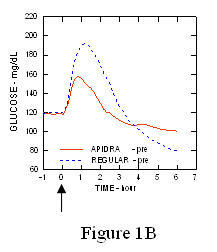
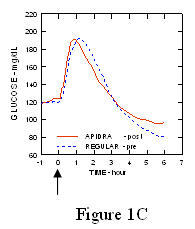
In een onderzoek bij patiënten met type 1 diabetes (n = 20), de glucoseverlagende profielen van Apidra en normale humane insuline werd op verschillende tijdstippen beoordeeld in relatie tot een standaardmaaltijd bij een dosis van 0,15 Eenheden / kg. (Figuur 1.)
De maximale bloedglucose-excursie (Î ”GLUmax; basiswaarde afgetrokken glucoseconcentratie) voor Apidra geïnjecteerd 2 minuten vóór een maaltijd was 65 mg / dL vergeleken met 64 mg / dL voor normale mensen insuline 30 minuten vóór een maaltijd geïnjecteerd (zie figuur 1A) en 84 mg / dL voor normale humane insuline 2 minuten vóór een maaltijd geïnjecteerd (zie figuur 1B). De maximale bloedglucose-excursie voor Apidra geïnjecteerd 15 minuten na het begin van een maaltijd was 85 mg / dL vergeleken met 84 mg / dL voor normale humane insuline die 2 minuten vóór een maaltijd werd geïnjecteerd (zie figuur 1C).
Figuur 1. Seriële gemiddelde bloedglucose verzameld tot 6 uur na een enkele dosis Apidra en normale humane insuline. Apidra 2 minuten toegediend (Apidra - pre) vóór het begin van een maaltijd in vergelijking met reguliere humane insuline die 30 minuten wordt gegeven (Normaal - 30 min) vóór het begin van de maaltijd (Figuur 1A) en vergeleken met gewone humane insuline (Normaal - pre) 2 minuten vóór een maaltijd toegediend (Figuur 1B). Apidra 15 minuten toegediend (Apidra - post) na het begin van een maaltijd in vergelijking met gewone humane insuline (Normaal - pre) 2 minuten vóór een maaltijd toegediend (Figuur 1C). Op de x-as nul (0) is het begin van een maaltijd van 15 minuten.
 |
 |
 |
 |
In een gerandomiseerde, open-label, tweerichtingscrossover-studie ontvingen 16 gezonde mannelijke proefpersonen een intraveneuze infusie van Apidra of gewone humane insuline met zoutoplossing met een snelheid van 0,8 milliUits / kg / min voor twee uur. Infusie van dezelfde dosis Apidra of gewone humane insuline veroorzaakte een gelijkwaardige glucose-afvoer bij steady-state.
farmacokinetiek
Absorptie en biologische beschikbaarheid
Farmacokinetische profielen bij gezonde vrijwilligers en patiënten met diabetes (type 1 of type 2) toonden aan dat de absorptie van insuline glulisine sneller was dan die van gewone humane insuline.
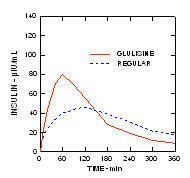
In een onderzoek bij patiënten met type 1 diabetes (n = 20) na subcutane toediening van 0,15 eenheden / kg, de mediane tijd tot maximale concentratie (Tmax) was 60 minuten (bereik 40 tot 120 minuten) en de piekconcentratie (Cmax) was 83 micro-eenheden / ml (bereik 40 tot 131 micro-eenheden / ml) voor insuline glulisine vergeleken met een mediane Tmax van 120 minuten (bereik 60 tot 239 minuten) en een Cmax van 50 micro-eenheden / ml (bereik 35 tot 71 micro-eenheden / ml) voor normale mensen insuline. (Figuur 2)
Figuur 2. Farmacokinetische profielen van insuline glulisine en gewone humane insuline bij patiënten met diabetes type 1 na een dosis van 0,15 eenheden / kg.
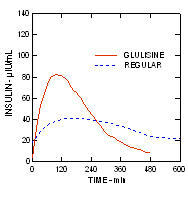
Insuline glulisine en normale humane insuline werden subcutaan toegediend in een dosis van 0,2 eenheden / kg in een euglycemische klemstudie bij patiënten met diabetes type 2 (n = 24) en een body mass index (BMI) tussen 20 en 36 kg / m2. De mediane tijd tot maximale concentratie (Tmax) was 100 minuten (bereik 40 tot 120 minuten) en de mediane piekconcentratie (Cmax) was 84 micro-eenheden / ml (bereik 53 tot 165 micro-eenheden / ml) voor insuline glulisine vergeleken met een mediane Tmax van 240 minuten (bereik 80 tot 360 minuten) en een mediane Cmax van 41 micro-eenheden / ml (bereik 33 tot 61 micro-eenheden / ml) voor normale humane insuline. (Figuur 3.)
figuur 3. Farmacokinetische profielen van insuline glulisine en gewone humane insuline bij patiënten met diabetes type 2 na een subcutane dosis van 0,2 eenheden / kg.
Toen Apidra subcutaan in verschillende delen van het lichaam werd geïnjecteerd, waren de tijdconcentratieprofielen vergelijkbaar. De absolute biologische beschikbaarheid van insuline glulisine na subcutane toediening is ongeveer 70%, ongeacht het injectieoppervlak (buik 73%, deltoïde 71%, dij 68%).
In een klinisch onderzoek bij gezonde vrijwilligers (n = 32) was de totale biologische beschikbaarheid van insuline glulisine vergelijkbaar na subcutane injectie van insuline glulisine en NPH-insuline (voorgemengd in de spuit) en na afzonderlijke gelijktijdige subcutane injectie injecties. Er was 27% verzwakking van de maximale concentratie (Cmax) van Apidra na het voormengen; de tijd tot maximale concentratie (Tmax) werd echter niet beïnvloed. Er zijn geen gegevens beschikbaar over het mengen van Apidra met andere insulinepreparaten dan NPH-insuline. [Zien Klinische studies].
Distributie en eliminatie
De verdeling en eliminatie van insuline glulisine en normale humane insuline na intraveneuze toediening administratie zijn vergelijkbaar met distributievolumes van 13 en 21 L en halfwaardetijden van 13 en 17 minuten, respectievelijk. Na subcutane toediening wordt insuline glulisine sneller geëlimineerd dan gewone humane insuline met een schijnbare halfwaardetijd van 42 minuten vergeleken met 86 minuten.
Klinische farmacologie in specifieke populaties
Pediatrische patiënten
De farmacokinetische en farmacodynamische eigenschappen van Apidra en reguliere humane insuline werden beoordeeld in een studie uitgevoerd bij kinderen van 7 tot 11 jaar oud (n = 10) en adolescenten van 12 tot 16 jaar oud (n = 10) met type 1 diabetes. De relatieve verschillen in farmacokinetiek en farmacodynamiek tussen Apidra en reguliere humane insuline in deze patiënten met type 1 diabetes waren vergelijkbaar met die bij gezonde volwassen personen en volwassenen met type 1 diabetes.
Ras
Een studie bij 24 gezonde blanken en Japanse proefpersonen vergeleek de farmacokinetiek en farmacodynamiek na subcutane injectie van insuline glulisine, insuline lispro en reguliere humane insuline. Met subcutane injectie van insuline glulisine hadden Japanse proefpersonen een grotere initiële blootstelling (33%) voor de verhouding van AUC (0-1 uur) tot AUC (0-klem einde) dan blanken (21%), hoewel de totale blootstellingen vergelijkbaar. Er waren vergelijkbare bevindingen met insuline lispro en gewone humane insuline.
zwaarlijvigheid
Insuline glulisine en gewone humane insuline werden subcutaan toegediend in een dosis van 0,3 eenheden / kg in a euglycemische klemstudie bij obese, niet-diabetische personen (n = 18) met een body mass index (BMI) tussen 30 en 40 kg / m2. De mediane tijd tot maximale concentratie (Tmax) was 85 minuten (bereik 49 tot 150 minuten) en de mediane piekconcentratie (Cmax) was 192 micro-eenheden / ml (bereik 98 tot 380 micro-eenheden / ml) voor insuline glulisine vergeleken met een mediane Tmax van 150 minuten (bereik 90 tot 240 minuten) en een mediane Cmax van 86 micro-eenheden / ml (bereik 43 tot 175 micro-eenheden / ml) voor normale mensen insuline.
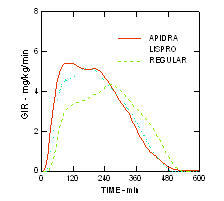
Het snellere begin van de actie en kortere activiteitsduur van Apidra en insuline lispro in vergelijking met gewone humane insuline werden gehandhaafd in een obese niet-diabetische populatie (n = 18). (Figuur 4.)
Figuur 4. Glucose-infusiesnelheden (GIR) in een euglycemische klemstudie na subcutane injectie van 0,3 eenheden / kg Apidra, insuline lispro of gewone humane insuline bij een zwaarlijvige populatie.
Nierfunctiestoornis
Studies met humane insuline hebben verhoogde circulerende insulinespiegels aangetoond bij patiënten met nierfalen. In een onderzoek uitgevoerd bij 24 niet-diabetespatiënten met normale nierfunctie (ClCr> 80 ml / min), matige nierfunctiestoornis (30-50 ml / min) en ernstige nierfunctiestoornis (waarschuwingen en voorzorgen).
Leverinsufficiëntie
Het effect van leverinsufficiëntie op de farmacokinetiek en farmacodynamiek van Apidra is niet onderzocht. Sommige onderzoeken met humane insuline hebben verhoogde circulerende insulinespiegels aangetoond bij patiënten met leverfalen. [Zien Waarschuwingen en voorzorgsmaatregelen].
Geslacht
Het effect van geslacht op de farmacokinetiek en farmacodynamiek van Apidra is niet onderzocht.
Zwangerschap
Het effect van zwangerschap op de farmacokinetiek en farmacodynamiek van Apidra is niet onderzocht.
Roken
Het effect van roken op de farmacokinetiek en farmacodynamiek van Apidra is niet onderzocht.
top
Niet-klinische Toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Standaard 2-jarige carcinogeniteitsstudies bij dieren zijn niet uitgevoerd. Bij Sprague Dawley-ratten werd een onderzoek naar toxiciteit bij herhaalde toediening van 12 maanden uitgevoerd met insuline glulisine bij subcutane doses van 2,5, 5, 20 of 50 eenheden / kg tweemaal daags (dosis resulterend in een blootstelling 1, 2, 8 en 20 keer de gemiddelde dosis voor mensen, gebaseerd op lichaamsoppervlak vergelijking).
Er was een niet-dosisafhankelijke hogere incidentie van borstkliertumoren bij vrouwelijke ratten waaraan insuline glulisine werd toegediend in vergelijking met onbehandelde controles. De incidentie van borsttumoren voor insuline glulisine en normale humane insuline was vergelijkbaar. De relevantie van deze bevindingen voor de mens is niet bekend. Insuline glulisine was niet mutageen in de volgende tests: Ames-test, in vitro chromosoom bij zoogdieren aberratietest in V79 Chinese hamstercellen en in vivo zoogdier erytrocyt micronucleustest in ratten.
In vruchtbaarheidsonderzoeken bij mannelijke en vrouwelijke ratten bij subcutane doses tot 10 eenheden / kg eenmaal daags (dosis resulterend in een blootstelling die 2 keer de gemiddelde menselijke dosis, op basis van vergelijking van het lichaamsoppervlak), geen duidelijke nadelige effecten op de mannelijke en vrouwelijke vruchtbaarheid, of algemene reproductieve prestaties van dieren opgemerkt.
top
Klinische studies
De veiligheid en werkzaamheid van Apidra is onderzocht bij volwassen patiënten met type 1 en type 2 diabetes (n = 1833) en bij kinderen en adolescente patiënten (4 tot 17 jaar) met type 1 diabetes (n = 572). De primaire werkzaamheidsparameter in deze onderzoeken was glycemische controle, beoordeeld met behulp van geglyceerd hemoglobine (GHb gerapporteerd als HbA1c-equivalent).
Type 1 diabetes-volwassenen
Een 26 weken durende, gerandomiseerde, open-label, actief gecontroleerde, niet-inferioriteitsstudie werd uitgevoerd bij patiënten met type 1 diabetes om de veiligheid en werkzaamheid van Apidra (n = 339) vergeleken met insuline lispro (n = 333) wanneer subcutaan toegediend binnen 15 minuten vóór een maaltijd. Insuline glargine werd eenmaal daags 's avonds toegediend als basale insuline. Er was een inloopperiode van 4 weken met insuline lispro en insuline glargine voorafgaand aan randomisatie. De meeste patiënten waren blank (97%). Achtenvijftig procent van de patiënten waren mannen. De gemiddelde leeftijd was 39 jaar (bereik 18 tot 74 jaar). Glycemische controle, het aantal dagelijkse kortwerkende insuline-injecties en de totale dagelijkse doses van Apidra en insuline lispro waren vergelijkbaar in de twee behandelingsgroepen (tabel 6).
Tabel 6: Type 1 Diabetes Mellitus - Volwassene
| Behandelingsduur Behandeling in combinatie met: |
26 weken Insuline glargine |
|
|---|---|---|
| Apidra | Insuline Lispro | |
| ||
| Glycated hemoglobine (GHb)* (%) | ||
| Aantal patiënten | 331 | 322 |
| Baseline gemiddelde | 7.6 | 7.6 |
| Aangepaste gemiddelde verandering ten opzichte van de uitgangswaarde | -0.1 | -0.1 |
| Verschil in behandeling: Apidra - Insulin Lispro | 0.0 | |
| 95% BI voor behandelingsverschil | (-0.1; 0.1) | |
| Basale insulinedosis (eenheden / dag) | ||
| Baseline gemiddelde | 24 | 24 |
| Aangepaste gemiddelde verandering ten opzichte van de uitgangswaarde | 0 | 2 |
| Kortwerkende insulinedosis (eenheden / dag) | ||
| Baseline gemiddelde | 30 | 31 |
| Aangepaste gemiddelde verandering ten opzichte van de uitgangswaarde | -1 | -1 |
| Gemiddeld aantal kortwerkende insuline-injecties per dag | 3 | 3 |
| Lichaamsgewicht (kg) | ||
| Baseline gemiddelde | 73.9 | 74.1 |
| Gemiddelde verandering ten opzichte van baseline | 0.6 | 0.3 |
Type 2 diabetes-volwassenen
Een 26 weken durende, gerandomiseerde, open-label, actief gecontroleerde, niet-inferioriteitsstudie werd uitgevoerd bij met insuline behandelde patiënten met type 2 diabetes om de veiligheid en werkzaamheid van Apidra (n = 435) toegediend binnen 15 minuten vóór een maaltijd vergeleken met reguliere humane insuline (n = 441) toegediend 30 tot 45 minuten voorafgaand aan een maaltijd. NPH humane insuline werd tweemaal daags toegediend als basale insuline. Alle patiënten namen deel aan een inloopperiode van 4 weken met gewone humane insuline en NPH humane insuline. Vijfentachtig procent van de patiënten was blank en 11% was zwart. De gemiddelde leeftijd was 58 jaar (bereik 26 tot 84 jaar). De gemiddelde body mass index (BMI) was 34,6 kg / m2. Bij randomisatie gebruikte 58% van de patiënten een oraal antidiabetisch middel. Deze patiënten kregen de instructie om hun orale antidiabetica in dezelfde dosis tijdens het onderzoek te blijven gebruiken. De meerderheid van de patiënten (79%) mengde hun kortwerkende insuline onmiddellijk voorafgaand aan injectie met humane NPH-insuline. De verminderingen ten opzichte van de uitgangswaarde in GHb waren vergelijkbaar tussen de 2 behandelingsgroepen (zie tabel 7). Er werden geen verschillen gezien tussen Apidra en reguliere humane insuline-groepen in het aantal dagelijkse kortwerkende insuline-injecties of basale of kortwerkende insulinedoses. (Zie tabel 7.)
Tabel 7: Type 2 diabetes mellitus-volwassene
| Behandelingsduur | 26 weken | |
|---|---|---|
| Behandeling in combinatie met: | NPH menselijke insuline | |
| Apidra | Regelmatige menselijke insuline | |
| ||
| Glycated hemoglobine (GHb)* (%) | ||
| Aantal patiënten | 404 | 403 |
| Baseline gemiddelde | 7.6 | 7.5 |
| Aangepaste gemiddelde verandering ten opzichte van de uitgangswaarde | -0.5 | -0.3 |
| Verschil in behandeling: Apidra - Regelmatige humane insuline | -0.2 | |
| 95% BI voor behandelingsverschil | (-0.3; -0.1) | |
| Basale insulinedosis (eenheden / dag) | ||
| Baseline gemiddelde | 59 | 57 |
| Aangepaste gemiddelde verandering ten opzichte van de uitgangswaarde | 6 | 6 |
| Kortwerkende insulinedosis (eenheden / dag) | ||
| Baseline gemiddelde | 32 | 31 |
| Aangepaste gemiddelde verandering ten opzichte van de uitgangswaarde | 4 | 5 |
| Gemiddeld aantal kortwerkende insuline-injecties per dag | 2 | 2 |
| Lichaamsgewicht (kg) | ||
| Baseline gemiddelde | 100.5 | 99.2 |
| Gemiddelde verandering ten opzichte van baseline | 1.8 | 2.0 |
Type 1 diabetes-volwassenen: toediening vóór en na de maaltijd
Een 12 weken durende, gerandomiseerde, open-label, actief gecontroleerde, niet-inferioriteitsstudie werd uitgevoerd bij patiënten met type 1 diabetes om de veiligheid en werkzaamheid van Apidra toegediend op verschillende tijdstippen met betrekking tot een maaltijd. Apidra werd subcutaan toegediend binnen 15 minuten vóór een maaltijd (n = 286) of onmiddellijk na een maaltijd (n = 296) en normale humane insuline (n = 278) werden 30 tot 45 minuten voorafgaand aan een subcutaan toegediend maaltijd. Insuline glargine werd eenmaal daags voor het slapengaan toegediend als basale insuline. Er was een inloopperiode van 4 weken met reguliere humane insuline en insuline glargine gevolgd door randomisatie. De meeste patiënten waren blank (94%). De gemiddelde leeftijd was 40 jaar (bereik 18 tot 73 jaar). Glycemische controle (zie tabel 8) was vergelijkbaar voor de 3 behandelingsregimes. Er werden geen veranderingen ten opzichte van de uitgangswaarde tussen de behandelingen gezien in het totale dagelijkse aantal kortwerkende insuline-injecties. (Zie tabel 8.)
Tabel 8: Toediening vóór en na de maaltijd bij type 1 diabetes mellitus-volwassene
| Behandelingsduur Behandeling in combinatie met: |
12 weken insuline glargine |
12 weken insuline glargine |
12 weken insuline glargine |
|---|---|---|---|
| Apidra voor de maaltijd |
Apidra na de maaltijd |
Regelmatige menselijke insuline | |
| |||
| Glycated hemoglobine (GHb)* (%) | |||
| Aantal patiënten | 268 | 276 | 257 |
| Baseline gemiddelde | 7.7 | 7.7 | 7.6 |
| Aangepaste gemiddelde verandering ten opzichte van de uitgangswaarde†| -0.3 | -0.1 | -0.1 |
| Basale insulinedosis (eenheden / dag) | |||
| Baseline gemiddelde | 29 | 29 | 28 |
| Aangepaste gemiddelde verandering ten opzichte van de uitgangswaarde | 1 | 0 | 1 |
| Kortwerkende insulinedosis (eenheden / dag) | |||
| Baseline gemiddelde | 29 | 29 | 27 |
| Aangepaste gemiddelde verandering ten opzichte van de uitgangswaarde | -1 | -1 | 2 |
| Gemiddeld aantal kortwerkende insuline-injecties per dag | 3 | 3 | 3 |
| Lichaamsgewicht (kg) | |||
| Baseline gemiddelde | 79.2 | 80.3 | 78.9 |
| Gemiddelde verandering ten opzichte van baseline | 0.3 | -0.3 | 0.3 |
Type 1 diabetes-pediatrische patiënten
Een 26 weken durende, gerandomiseerde, open-label, actief gecontroleerde, niet-inferioriteitsstudie werd uitgevoerd bij kinderen en adolescenten ouder dan 4 jaar met type 1 diabetes mellitus om de veiligheid en werkzaamheid van Apidra (n = 277) te beoordelen in vergelijking met insuline lispro (n = 295) wanneer subcutaan toegediend binnen 15 minuten vóór een maaltijd. Patiënten ontvingen ook insuline glargine (eenmaal daags 's avonds toegediend) of NPH-insuline (eenmaal' s ochtends en eenmaal 's avonds toegediend). Er was een inloopperiode van 4 weken met insuline lispro en insuline glargine of NPH voorafgaand aan randomisatie. De meeste patiënten waren blank (91%). Vijftig procent van de patiënten was man. De gemiddelde leeftijd was 12,5 jaar (bereik 4 tot 17 jaar). Gemiddelde BMI was 20,6 kg / m2. Glycemische controle (zie tabel 9) was vergelijkbaar voor de twee behandelingsregimes.
Tabel 9: Resultaten van een 26 weken durende studie bij pediatrische patiënten met diabetes mellitus type 1
| Apidra | lispro | |
|---|---|---|
| Aantal patiënten | 271 | 291 |
| Basale insuline | NPH of insuline glargine | NPH of insuline glargine |
| ||
| Glycated hemoglobine (GHb)* (%) | ||
| Baseline gemiddelde | 8.2 | 8.2 |
| Aangepaste gemiddelde verandering ten opzichte van de uitgangswaarde | 0.1 | 0.2 |
| Behandelingsverschil: gemiddeld (95% betrouwbaarheidsinterval) | -0.1 (-0.2, 0.1) | |
| Basale insulinedosis (eenheden / kg / dag) | ||
| Baseline gemiddelde | 0.5 | 0.5 |
| Gemiddelde verandering ten opzichte van baseline | 0.0 | 0.0 |
| Kortwerkende insulinedosis (eenheden / kg / dag) | ||
| Baseline gemiddelde | 0.5 | 0.5 |
| Gemiddelde verandering ten opzichte van baseline | 0.0 | 0.0 |
| Gemiddeld aantal kortwerkende insuline-injecties per dag | 3 | 3 |
| Gemiddeld lichaamsgewicht bij aanvang (kg) | 51.5 | 50.8 |
| Gemiddelde gewichtsverandering ten opzichte van de uitgangswaarde (kg) | 2.2 | 2.2 |
Type 1 diabetes-volwassenen: continue subcutane insuline-infusie
Een 12 weken durende gerandomiseerde, actieve controle studie (Apidra versus insuline aspart) uitgevoerd bij volwassenen met type 1 diabetes (Apidra n = 29, insuline aspart n = 30) evalueerde het gebruik van Apidra in een externe continue subcutane insuline pomp. Alle patiënten waren blank. De gemiddelde leeftijd was 46 jaar (bereik 21 tot 73 jaar). Het gemiddelde GHb steeg van uitgangswaarde tot eindpunt in beide behandelingsgroepen (van 6,8% tot 7,0% voor Apidra; van 7,1% tot 7,2% voor insuline aspart).
top
Hoe geleverd / opslag en gebruik
Hoe geleverd
| |
| Apidra 100 eenheden per ml (U-100) is beschikbaar als: | |
| 10 ml flesjes | NDC 0088-2500-33 |
| 3 ml cartridgesysteem*, pakket van 5 | NDC 0088-2500-52 |
| 3 ml SoloStar voorgevulde pen, verpakking van 5 | NDC 0088-2502-05 |
Pennaalden zijn niet inbegrepen in de pakketten.
BD Ultra-Fine ™ pennaalden1 voor gebruik in combinatie met OptiClik worden apart verkocht en worden vervaardigd door Becton Dickinson and Company.
Solostar is compatibel met alle pennaalden van Becton Dickinson and Company, Ypsomed en Owen Mumford.
opslagruimte
Niet gebruiken na de vervaldatum (zie doos en verpakking).
Ongeopende injectieflacon / cartridgesysteem / SoloStar
Ongeopende injectieflacons Apidra, patroonsystemen en SoloStar moeten worden bewaard in de koelkast, 2 ° C - 8 ° C (36 ° F-46 ° F). Bescherm tegen licht. Apidra mag niet in de vriezer worden bewaard en mag niet worden ingevroren. Gooi weg als het bevroren is.
Ongeopende injectieflacons / cartridgesystemen / SoloStar die niet in de koelkast zijn bewaard, moeten binnen 28 dagen worden gebruikt.
Open (in gebruik) flacon:
Geopende injectieflacons, al dan niet gekoeld, moeten binnen 28 dagen worden gebruikt. Als koeling niet mogelijk is, kan de open flacon die in gebruik is maximaal 28 dagen ongekoeld bewaard worden, uit de buurt van directe hitte en licht, zolang de temperatuur niet hoger is dan 25 ° C (77 ° F).
Open (in gebruik) cartridgesysteem:
Het geopende (in gebruik) cartridgesysteem dat in OptiClik® is ingebracht, mag NIET worden gekoeld, maar moet onder 25 ° C (77 ° F) uit de buurt van directe hitte en licht worden bewaard. Het geopende (in gebruik) cartridgesysteem moet na 28 dagen worden weggegooid. Bewaar OptiClik® nooit met of zonder cartridgesysteem in de koelkast.
Open (in gebruik) SoloStar voorgevulde pen:
De geopende (in gebruik) SoloStar mag NIET worden gekoeld, maar moet onder 25 ° C (77 ° F) uit de buurt van directe hitte en licht worden bewaard. De geopende (in gebruik) SoloStar bewaard bij kamertemperatuur moet na 28 dagen worden weggegooid.
Infuussets:
Infusiesets (reservoirs, slangen en katheters) en de Apidra in het reservoir moeten worden weggegooid na 48 uur gebruik of na blootstelling aan temperaturen hoger dan 98,6 ° F (37 ° C).
Intraveneus gebruik:
Infuuszakken bereid zoals aangegeven onder DOSERING EN ADMINISTRATIE zijn 48 uur stabiel bij kamertemperatuur.
Voorbereiding en behandeling
Na verdunning voor intraveneus gebruik moet de oplossing vóór toediening visueel worden geïnspecteerd op deeltjes en verkleuring. Gebruik de oplossing niet als deze troebel is geworden of deeltjes bevat; gebruik alleen als het helder en kleurloos is. Apidra is niet compatibel met Dextrose-oplossing en Ringers-oplossing en kan daarom niet worden gebruikt met deze oplossingsvloeistoffen. Het gebruik van Apidra met andere oplossingen is niet onderzocht en wordt daarom niet aanbevolen.
Cartridgesysteem: Als OptiClik® (het insulinetoedieningsapparaat voor Apidra) niet goed werkt, kan Apidra uit het cartridgesysteem in een U-100-spuit worden getrokken en geïnjecteerd.
Apidra, insuline glusine, patiëntinformatie (In gewoon Engels)
laatst bijgewerkt: 02/2009
Gedetailleerde informatie over tekenen, symptomen, oorzaken, behandelingen van diabetes
De informatie in deze monografie is niet bedoeld om alle mogelijke toepassingen, aanwijzingen, voorzorgsmaatregelen, interacties tussen geneesmiddelen of bijwerkingen te dekken. Deze informatie is algemeen en is niet bedoeld als specifiek medisch advies. Neem contact op met uw arts, apotheker of verpleegkundige als u vragen heeft over de medicijnen die u gebruikt of meer informatie wilt.
terug naar: Blader door alle medicijnen voor diabetes



