Provigil: behandeling voor waakzaamheid (volledige voorschriftinformatie)
Merknaam: Provigil
Generieke naam: Modafinil
Inhoud:
Beschrijving
farmacologie
Klinische paden
Aanwijzingen en gebruik
Contra
waarschuwingen
Voorzorgsmaatregelen
Bijwerkingen
Drugsmisbruik en afhankelijkheid
overdosering
Dosering en administratie
Hoe geleverd
Provigil (modafinil) patiëntinformatieblad (In gewoon Engels)
Beschrijving
Provigil (modafinil) is een middel dat de wakkerheid bevordert voor orale toediening. Modafinil is een racemische verbinding. De chemische naam voor modafinil is 2 - [(difenylmethyl) sulfinyl] aceetamide. De molecuulformule is C15H15N02S en het molecuulgewicht is 273,35.
De chemische structuur is:
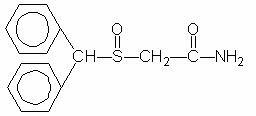
Modafinil is een wit tot gebroken wit, kristallijn poeder dat praktisch onoplosbaar is in water en cyclohexaan. Het is spaarzaam tot weinig oplosbaar in methanol en aceton. Provigil-tabletten bevatten 100 mg of 200 mg modafinil en de volgende inactieve ingrediënten: lactose, microkristallijne cellulose, gepregelatiniseerd zetmeel, natriumcroscarmellose, povidon en magnesium stearaat.
top
Klinische Farmacologie
Werkingsmechanisme en farmacologie
Het precieze mechanisme (n) waardoor modafinil waakzaamheid bevordert, is onbekend. Modafinil heeft wake-bevorderende acties vergelijkbaar met sympathicomimetische middelen zoals amfetamine en methylfenidaat, hoewel het farmacologische profiel niet identiek is aan dat van sympathicomimetische amines.
Modafinil heeft zwakke tot verwaarloosbare interacties met receptoren voor norepinefrine, serotonine, dopamine, GABA, adenosine, histamine-3, melatonine en benzodiazepines. Modafinil remt ook de activiteiten van MAO-B of fosfodiesterasen II-V niet.
Door modafinil geïnduceerde waakzaamheid kan worden verzwakt door de Î ± 1-adrenerge receptorantagonist prazosine; modafinil is echter inactief in andere in vitro testsystemen waarvan bekend is dat ze reageren op Î ± -adrenerge agonisten, zoals de bereiding van ratten vas deferens.
Modafinil is geen direct of indirect werkende dopaminereceptoragonist. In vitro bindt modafinil echter aan de dopamine-transporter en remt de heropname van dopamine. Deze activiteit is in vivo geassocieerd met verhoogde extracellulaire dopamine-niveaus in sommige hersengebieden van dieren. Bij genetisch gemanipuleerde muizen zonder de dopamine-transporter (DAT), had modafinil geen wake-bevorderende activiteit, wat suggereert dat deze activiteit DAT-afhankelijk was. De wakkerbevorderende effecten van modafinil werden echter, in tegenstelling tot die van amfetamine, niet tegengewerkt door de dopamine-receptorantagonist haloperidol bij ratten. Bovendien blokkeert alfa-methyl-p-tyrosine, een dopamine-syntheseremmer, de werking van amfetamine, maar blokkeert niet de motorische activiteit die wordt geïnduceerd door modafinil.
Bij de kat verhoogden gelijke doses die methylfenidaat en amfetamine bevorderen de neuronale activering in de hersenen. Modafinil bij een equivalente wakkerheidbevorderende dosis selectief en prominent verhoogde neuronale activering in meer discrete hersengebieden. Het verband tussen deze bevinding bij katten en de effecten van modafinil bij mensen is onbekend.
Naast de wake-bevorderende effecten en het vermogen om de motorische activiteit bij dieren te verhogen, produceert modafinil psychoactieve en euforische effecten, veranderingen in stemming, perceptie, denken en gevoelens die typerend zijn voor andere CZS-stimulerende middelen in mensen. Modafinil heeft versterkende eigenschappen, zoals blijkt uit zijn zelftoediening bij apen die eerder zijn getraind om zelf cocaïne toe te dienen. Modafinil werd ook gedeeltelijk gediscrimineerd als stimulerend.
De optische enantiomeren van modafinil hebben vergelijkbare farmacologische effecten bij dieren. Twee belangrijke metabolieten van modafinil, modafinilzuur en modafinil sulfon, lijken niet bij te dragen aan de CNS-activerende eigenschappen van modafinil.
farmacokinetiek
Modafinil is een racemische verbinding, waarvan de enantiomeren verschillende farmacokinetiek hebben (bijvoorbeeld de halfwaardetijd van het l-isomeer is ongeveer driemaal die van het d-isomeer bij volwassen mensen). De enantiomeren wisselen elkaar niet uit. In steady-state is de totale blootstelling aan het l-isomeer ongeveer driemaal die voor het d-isomeer. De dalconcentratie (Cminss) van circulerend modafinil na eenmaal daagse dosering bestaat uit 90% van het l-isomeer en 10% van het d-isomeer. De effectieve eliminatiehalfwaardetijd van modafinil na meerdere doses is ongeveer 15 uur. De enantiomeren van modafinil vertonen lineaire kinetiek bij meervoudige dosering van 200-600 mg / dag eenmaal daags bij gezonde vrijwilligers. Schijnbare stabiele toestanden van totale modafinil en l - (-) - modafinil worden na 2-4 dagen dosering bereikt.
Absorptie
De absorptie van Provigil-tabletten is snel, met piekplasmaconcentraties die na 2-4 uur optreden. De biologische beschikbaarheid van Provigil-tabletten is ongeveer gelijk aan die van een waterige suspensie. De absolute orale biologische beschikbaarheid werd niet bepaald vanwege de onoplosbaarheid in water (<1 mg / ml) van modafinil, waardoor intraveneuze toediening werd uitgesloten. Voedsel heeft geen effect op de algehele biologische beschikbaarheid van Provigil; de absorptie ervan (tmax) kan met ongeveer een uur worden uitgesteld indien ingenomen met voedsel.
Distributie
Modafinil is goed verdeeld in lichaamsweefsel met een schijnbaar distributievolume (~ 0,9 L / kg) groter dan het volume van het totale lichaamswater (0,6 L / kg). In menselijk plasma is modafinil in vitro matig gebonden aan plasma-eiwitten (~ 60%, voornamelijk aan albumine). Bij serumconcentraties verkregen in steady-state na doses van 200 mg / dag vertoont modafinil geen verplaatsing van eiwitbinding van warfarine, diazepam of propranolol. Zelfs bij veel grotere concentraties (1000 µM; > 25 keer de Cmax van 40 µM in steady-state met 400 mg / dag), modafinil heeft geen effect op warfarine binding. Modafinilzuur bij concentraties> 500 µM verlaagt de mate van warfarine binding, maar deze concentraties zijn> 35 maal die therapeutisch bereikt.
Metabolisme en eliminatie
De belangrijkste eliminatieroute is metabolisme (~ 90%), voornamelijk door de lever, met daaropvolgende renale eliminatie van de metabolieten. Urine-alkalisatie heeft geen effect op de eliminatie van modafinil.
Metabolisme vindt plaats door hydrolytische deamidatie, S-oxidatie, aromatische ringhydroxylatie en glucuronide-conjugatie. Minder dan 10% van een toegediende dosis wordt als de moederverbinding uitgescheiden. In een klinisch onderzoek met radioactief gelabeld modafinil werd in totaal 81% van de toegediende radioactiviteit teruggevonden in 11 dagen na de dosis, voornamelijk in de urine (80% vs. 1,0% in de ontlasting). De grootste fractie van het geneesmiddel in urine was modafinilzuur, maar ten minste zes andere metabolieten waren aanwezig in lagere concentraties. Slechts twee metabolieten bereiken aanzienlijke concentraties in plasma, d.w.z. modafinilzuur en modafinil sulfon. In preklinische modellen waren modafinilzuur, modafinilsulfon, 2 - [(difenylmethyl) sulfonyl] azijnzuur en 4-hydroxy modafinil inactief of leken het niet de bemoedigende effecten van modafinil te mediëren.
Bij volwassenen zijn afname van de dalconcentraties van modafinil soms waargenomen na meerdere weken doseren, wat suggereert auto-inductie, maar de omvang van de dalingen en de inconsistentie van hun optreden suggereren dat hun klinische betekenis is minimaal. Significante accumulatie van modafinilsulfon is waargenomen na meerdere doses vanwege de lange eliminatiehalfwaardetijd van 40 uur. Inductie van metaboliserende enzymen, vooral cytochroom P-450 (CYP) 3A4, is ook in vitro waargenomen na incubatie van primaire culturen van menselijke hepatocyten met modafinil en in vivo na verlengde toediening van modafinil bij 400 mg / dag. (Zie voor verdere bespreking van de effecten van modafinil op CYP-enzymactiviteiten VOORZORGSMAATREGELEN, Geneesmiddelinteracties.)
Geneesmiddel-geneesmiddel interacties:
Op basis van in-vitrogegevens wordt modafinil gedeeltelijk gemetaboliseerd door de 3A isoform-subfamilie van cytochroom in de lever P450 (CYP3A4). Bovendien kan modafinil CYP2C19 remmen, CYP2C9 onderdrukken en CYP3A4, CYP2B6 en CYP1A2 induceren. Omdat modafinil en modafinil sulfon omkeerbare remmers zijn van het geneesmiddelmetaboliserende enzym CYP2C19, gelijktijdige toediening van modafinil met geneesmiddelen zoals diazepam, fenytoïne en propranolol, die grotendeels via die weg worden geëlimineerd, kunnen de circulerende niveaus van die verbindingen. Bovendien, bij personen met een tekort aan het enzym CYP2D6 (d.w.z. 7-10% van de blanke bevolking; vergelijkbaar of lager in andere populaties), de niveaus van CYP2D6-substraten zoals tricyclische antidepressiva en selectieve serotonine heropname remmers, die bijkomende eliminatieroutes hebben via CYP2C19, kunnen worden verhoogd door gelijktijdige toediening van modafinil. Dosisaanpassingen kunnen nodig zijn voor patiënten die met deze en soortgelijke medicijnen worden behandeld (zie VOORZORGSMAATREGELEN, Interacties tussen geneesmiddelen). Een in vitro studie toonde aan dat armodafinil (een van de enantiomeren van modafinil) een substraat is van P-glycoproteïne.
Gelijktijdige toediening van modafinil met andere actieve CZS-geneesmiddelen zoals methylfenidaat en dextroamfetamine had geen significante invloed op de farmacokinetiek van beide geneesmiddelen.
Chronische toediening van 400 mg modafinil bleek de systemische blootstelling aan twee CYP3A4 te verminderen substraten, ethinylestradiol en triazolam, na orale toediening suggererend dat CYP3A4 was geweest geïnduceerd. Chronische toediening van modafinil kan de eliminatie van CYP3A4-substraten verhogen. Dosisaanpassingen kunnen nodig zijn voor patiënten die met deze en soortgelijke medicijnen worden behandeld (zie VOORZORGSMAATREGELEN, Interacties tussen geneesmiddelen).
Een duidelijke concentratie-gerelateerde onderdrukking van CYP2C9-activiteit werd waargenomen in menselijke hepatocyten na blootstelling aan modafinil in vitro suggereert dat er een potentieel is voor een metabole interactie tussen modafinil en de substraten van dit enzym (bijvoorbeeld S-warfarine, fenytoïne). In een interactiestudie bij gezonde vrijwilligers toonde chronische behandeling met modafinil echter geen significant effect op de farmacokinetiek van warfarine in vergelijking met placebo. (Zien VOORZORGSMAATREGELEN, Geneesmiddeleninteracties, andere geneesmiddelen, Warfarine).
Speciale populaties
Geslachtseffect:
De farmacokinetiek van modafinil wordt niet beïnvloed door geslacht.
Leeftijdseffect:
Een lichte afname (~ 20%) van de orale klaring (CL / F) van modafinil werd waargenomen in een onderzoek met enkele doses bij 200 mg bij 12 personen met een gemiddelde leeftijd van 63 jaar (bereik 53 - 72 jaar), maar de verandering werd niet waarschijnlijk geacht klinisch te zijn significant. In een onderzoek met meervoudige doses (300 mg / dag) bij 12 patiënten met een gemiddelde leeftijd van 82 jaar (bereik 67 - 87 jaar), was het gemiddelde niveaus van modafinil in plasma waren ongeveer twee keer die die historisch werden verkregen in gematchte jongere onderwerpen. Vanwege mogelijke effecten van de meerdere gelijktijdig gebruikte medicijnen waarmee de meeste patiënten werden behandeld behandeld, is het schijnbare verschil in de farmacokinetiek van modafinil mogelijk niet alleen te wijten aan de effecten van veroudering. De resultaten suggereren echter dat de klaring van modafinil bij ouderen kan worden verminderd (zie Dosering en administratie).
Race-effect:
De invloed van ras op de farmacokinetiek van modafinil is niet onderzocht.
Nierinsufficiëntie:
In een 200 mg modafinil-onderzoek met een enkele dosis beïnvloeden de farmacokinetiek van modafinil aanzienlijk, maar de blootstelling aan modafinilzuur (een inactieve metaboliet) was verhoogd 9-voudig (zie VOORZORGSMAATREGELEN).
Leverinsufficiëntie:
Farmacokinetiek en metabolisme werden onderzocht bij patiënten met levercirrose (6 mannen en 3 vrouwen). Drie patiënten hadden stadium B of B + cirrose (volgens de Child-criteria) en 6 patiënten hadden stadium C of C + cirrose. Klinisch waren 8 van de 9 patiënten icterisch en hadden allemaal ascites. Bij deze patiënten was de orale klaring van modafinil met ongeveer 60% verminderd en was de steady-state concentratie verdubbeld in vergelijking met normale patiënten. De dosis Provigil moet worden verlaagd bij patiënten met ernstige leverinsufficiëntie (zie VOORZORGSMAATREGELEN en Dosering en administratie).
top
Klinische paden
De effectiviteit van Provigil bij het verminderen van overmatige slaperigheid is vastgesteld in de volgende slaap aandoeningen: narcolepsie, obstructieve slaapapneu / hypopneu syndroom (OSAHS) en ploegendienststoornis (SWSD).
narcolepsie
De effectiviteit van Provigil bij het verminderen van de overmatige slaperigheid (ES) geassocieerd met narcolepsie werd vastgesteld in twee Amerikaanse 9 weken durende, multicenter, placebo-gecontroleerde, twee doses (200 mg per dag en 400 mg per dag) dubbelblinde onderzoeken met parallelle groepen van poliklinische patiënten die de ICD-9 en American Sleep Disorders Association criteria voor narcolepsie (die ook consistent zijn met de American Psychiatric Association DSM-IV-criteria). Deze criteria omvatten 1) terugkerende dutjes overdag of in slaap vallen die bijna dagelijks gedurende ten minste drie maanden voorkomen, plus plotseling bilateraal verlies van posturale spierspanning in combinatie met intense emotie (kataplexie) of 2) een klacht van overmatige slaperigheid of plotselinge spierzwakte met bijbehorende kenmerken: slaapverlamming, hypnagogische hallucinaties, automatisch gedrag, verstoorde grote slaap aflevering; en polysomnografie die een van het volgende aantoont: slaaplatentie minder dan 10 minuten of snelle oogbeweging (REM) slaaplatentie minder dan 20 minuten. Bovendien moesten alle patiënten voor deelname aan deze onderzoeken objectief overmatige slaperigheid overdag, een meervoudige slaap, hebben gedocumenteerd Latency-test (MSLT) met twee of meer REM-startperioden voor slaap en de afwezigheid van andere klinisch significante actieve medische of psychiatrische wanorde. De MSLT, een objectieve polysomnografische beoordeling overdag van het vermogen van de patiënt om in slaap te vallen in een niet-stimulerende omgeving, meet latentie (in minuten) om te beginnen met slapen gemiddeld over 4 testsessies met intervallen van 2 uur na nachtelijke polysomnografie. Voor elke testsessie kreeg de proefpersoon te horen dat hij rustig moest liggen en probeerde te slapen. Elke testsessie werd na 20 minuten beëindigd als er geen slaap optrad of 15 minuten na het begin van de slaap.
In beide studies waren de primaire effectiviteitsmetingen 1) slaaplatentie, zoals beoordeeld door de Maintenance of Wakefulness Test (MWT) en 2) de verandering in de algemene ziektestatus van de patiënt, zoals gemeten door de Clinical Global Impression of Change (CGI-C). Voor een succesvolle proef moesten beide maatregelen een aanzienlijke verbetering vertonen.
De MWT meet latentie (in minuten) voor het begin van de slaap gemiddeld over 4 testsessies met tussenpozen van 2 uur na nachtelijke polysomnografie. Voor elke testsessie werd de proefpersoon gevraagd om te proberen wakker te blijven zonder buitengewone maatregelen te nemen. Elke testsessie werd na 20 minuten beëindigd als er geen slaap optrad of 10 minuten na het begin van de slaap. De CGI-C is een 7-puntsschaal, gecentreerd op Geen verandering, en varieert van zeer veel slechter tot zeer veel verbeterd. Patiënten werden beoordeeld door beoordelaars die geen toegang hadden tot andere gegevens over de patiënten dan een maat voor de ernst van hun uitgangswaarde. Evaluatoren kregen geen specifieke richtlijnen over de criteria die ze moesten toepassen bij het beoordelen van patiënten.
Andere effectbeoordelingen waren de Multiple Sleep Latency Test (MSLT), Epworth Sleepiness Scale (ESS; een reeks vragen om de mate van slaperigheid in dagelijkse situaties te beoordelen) de Steer Clear Performance Test (SCPT; een computergebaseerde evaluatie van het vermogen van een patiënt om obstakels te vermijden in een gesimuleerde rijsituatie), standaard nachtelijke polysomnografie en het dagelijkse slaaplogboek van de patiënt. Patiënten werden ook beoordeeld met de Quality of Life in Narcolepsy (QOLIN) -schaal, die de gevalideerde gezondheidsvragenlijst SF-36 bevat.
Beide studies toonden verbetering in objectieve en subjectieve metingen van overmatige slaperigheid overdag voor zowel de doses van 200 mg als 400 mg in vergelijking met placebo. Patiënten behandeld met beide doses Provigil vertoonden een statistisch significant verbeterd vermogen om wakker te blijven op de MWT (alle p-waarden <0,001) bij weken 3, 6, 9 en laatste bezoek vergeleken met placebo en een statistisch significant grotere wereldwijde verbetering, zoals beoordeeld op de CGI-C-schaal (alle p-waarden <0.05).
De gemiddelde slaaplatenties (in minuten) op de MWT bij baseline voor de 2 gecontroleerde onderzoeken worden weergegeven in onderstaande tabel 1, samen met de gemiddelde verandering van baseline op de MWT bij het laatste bezoek.
De percentages patiënten die enige mate van verbetering vertoonden op de CGI-C in de twee klinische onderzoeken worden weergegeven in onderstaande tabel 2.
Vergelijkbare statistisch significante behandelingsgerelateerde verbeteringen werden waargenomen bij andere maatregelen voor bijzondere waardevermindering in 2003 narcolepsie, inclusief een door de patiënt beoordeeld niveau van slaperigheid overdag op de ESS (p <0,001 voor elke dosis in vergelijking met placebo).
Nachtslaap gemeten met polysomnografie werd niet beïnvloed door het gebruik van Provigil.
Obstructief slaapapneu / hypopneu syndroom (OSAHS)
De effectiviteit van Provigil bij het verminderen van de buitensporige slaperigheid geassocieerd met OSAHS werd vastgesteld in twee klinische onderzoeken. In beide studies waren patiënten ingeschreven die voldeden aan de internationale classificatie van slaapstoornissen (ICSD) -criteria voor OSAHS (die ook consistent zijn met de American Psychiatric Association DSM-IV criteria). Deze criteria omvatten ofwel: 1) overmatige slaperigheid of slapeloosheid, plus frequente afleveringen van verminderde ademhalen tijdens de slaap, en bijbehorende functies zoals luid snurken, ochtendhoofdpijn en een droge mond ontwaken; of 2) overmatige slaperigheid of slapeloosheid en polysomnografie die een van het volgende aantoont: meer dan vijf obstructieve apneus, elk langer dan 10 seconden, per uur van slaap en een of meer van de volgende: frequente opwinding uit slaap geassocieerd met de apneu, bradytachycardie en arteriële zuurstofverzadiging in samenhang met de apneus. Bovendien moesten alle patiënten, om aan deze onderzoeken deel te nemen, overmatige slaperigheid hebben, zoals aangetoond met een score â ¥ ¥ 10 op de Epworth Sleepiness Scale, ondanks behandeling met continue positieve luchtwegdruk (CPAP). Bewijs dat CPAP effectief was in het verminderen van afleveringen van apneu / hypopneu was vereist, samen met documentatie van CPAP-gebruik.
In de eerste studie, een 12 weken durende multicenter placebo-gecontroleerde studie, werden in totaal 327 patiënten gerandomiseerd om Provigil 200 mg / dag, Provigil 400 mg / dag of een bijpassende placebo te ontvangen. De meerderheid van de patiënten (80%) was volledig conform CPAP, gedefinieerd als CPAP-gebruik> 4 uur / nacht op> 70% nachten. De rest was gedeeltelijk CPAP-conform, gedefinieerd als CPAP gebruik 30% nachten. CPAP-gebruik werd gedurende het onderzoek voortgezet. De primaire maatstaven voor de werkzaamheid waren 1) slaaplatentie, zoals beoordeeld door de Maintenance of Wakefulness Test (MWT) en 2) de verandering in de algemene ziektestatus van de patiënt, zoals gemeten door de Clinical Global Impression of Change (CGI-C) in week 12 of de finale bezoek. (Zien Klinische paden, Narcolepsie hierboven voor een beschrijving van deze tests.)
Patiënten behandeld met Provigil vertoonden een statistisch significante verbetering van het vermogen om wakker blijven in vergelijking met met placebo behandelde patiënten zoals gemeten door de MWT (p <0,001) op eindpunt [Tafel 1]. Met Provigil behandelde patiënten vertoonden ook een statistisch significante verbetering van de klinische toestand zoals beoordeeld door de CGI-C-schaal (p <0,001) [tabel 2]. De twee doses Provigil deden hetzelfde.
In de tweede studie, een 4 weken durende multicenter placebo-gecontroleerde studie, werden 157 patiënten gerandomiseerd naar Provigil 400 mg / dag of placebo. Documentatie van regelmatig CPAP-gebruik (minimaal 4 uur / nacht op 70% van de nachten) was vereist voor alle patiënten. De primaire uitkomstmaat was de verandering van baseline op het ESS in week 4 of het laatste bezoek. De baseline ESS-scores voor de Provigil- en placebogroepen waren respectievelijk 14,2 en 14,4. In week 4 was de ESS verlaagd met 4,6 in de Provigil-groep en met 2,0 in de placebogroep, een verschil dat statistisch significant was (p <0,0001).
Nachtslaap gemeten met polysomnografie werd niet beïnvloed door het gebruik van Provigil.
Shift Work Sleep Disorder (SWSD)
De effectiviteit van Provigil voor de overmatige slaperigheid geassocieerd met SWSD werd aangetoond in een placebogecontroleerd klinisch onderzoek van 12 weken. In totaal 209 patiënten met chronische SWSD werden gerandomiseerd om Provigil 200 mg / dag of placebo te krijgen. Alle patiënten voldeden aan de internationale classificatie van slaapstoornissen (ICSD-10) criteria voor chronische SWSD (die zijn consistent met de criteria van de American Psychiatric Association DSM-IV voor Circadian Rhythm Sleep Disorder: Shift Work Type). Deze criteria omvatten 1) ofwel: a) een primaire klacht van overmatige slaperigheid of slapeloosheid die tijdelijk wordt geassocieerd met een werkperiode (meestal nachtarbeid) die treedt op tijdens de gebruikelijke slaapfase, of b) polysomnografie en de MSLT vertonen verlies van een normaal slaap-waakpatroon (d.w.z. gestoorde chronobiologische rhythmicity); en 2) geen enkele andere medische of mentale aandoening verklaart de symptomen, en 3) de symptomen voldoen niet aan de criteria voor elke andere slaapstoornis die slapeloosheid of overmatige slaperigheid veroorzaakt (bijvoorbeeld verandering van tijdzone [jetlag] syndroom).
Opgemerkt moet worden dat niet alle patiënten met een slaperige klacht die zich ook bezighouden met ploegendienst voldoen aan de criteria voor de diagnose van SWSD. In de klinische proef waren alleen patiënten opgenomen die ten minste 3 maanden symptomatisch waren.
Ingeschreven patiënten moesten ook minimaal 5 nachtdiensten per maand werken, overmatige slaperigheid bij de tijdstip van hun nachtdiensten (MSLT-score <6 minuten) en slapeloosheid overdag gedocumenteerd door een polysomnogram overdag (PSG).
De primaire effectiviteitsmetingen waren 1) slaaplatentie, zoals beoordeeld door de Multiple Sleep Latency Test (MSLT) uitgevoerd tijdens een gesimuleerde nachtdienst in week 12 of het laatste bezoek en 2) de verandering in de algemene ziektestatus van de patiënt, zoals gemeten door de Clinical Global Impression of Change (CGI-C) in week 12 of de finale bezoek. Patiënten die met Provigil werden behandeld, vertoonden een statistisch significante verlenging van de tijd tot het begin van de slaap in vergelijking met met placebo behandelde patiënten, gemeten aan de hand van de nachtelijke MSLT [tabel 1] (p <0,05). Verbetering van de CGI-C bleek ook statistisch significant te zijn (p <0,001). (Zien Klinische paden, Narcolepsie hierboven voor een beschrijving van deze tests.)
Overdag slaap gemeten met polysomnografie werd niet beïnvloed door het gebruik van Provigil.
HTML-klembord
| Wanorde | Meten | Provigil 200 mg * |
Provigil 400 mg * |
Placebo | |||
| * Aanzienlijk anders dan placebo voor alle onderzoeken (p <0,01 voor alle onderzoeken behalve SWSD, die p <0,05 was) | |||||||
| Baseline | Verandering van Baseline |
Baseline | Verandering van Baseline |
Baseline | Verander van Baseline |
||
| Narcolepsie I | MWT | 5.8 | 2.3 | 6.6 | 2.3 | 5.8 | -0.7 |
| Narcolepsie II | MWT | 6.1 | 2.2 | 5.9 | 2.0 | 6.0 | -0.7 |
| OSAHS | MWT | 13.1 | 1.6 | 13.6 | 1.5 | 13.8 | -1.1 |
| SWSD | MSLT | 2.1 | 1.7 | - | - | 2.0 | 0.3 |
| Wanorde | Provigil 200 mg * |
Provigil 400 mg * |
Placebo |
| * Aanzienlijk anders dan placebo voor alle onderzoeken (p <0,01) | |||
| Narcolepsie I | 64% | 72% | 37% |
| Narcolepsie II | 58% | 60% | 38% |
| OSAHS | 61% | 68% | 37% |
| SWSD | 74% | - | 36% |
top
Aanwijzingen en gebruik
Provigil is geïndiceerd voor het verbeteren van waakzaamheid bij volwassen patiënten met overmatige slaperigheid geassocieerd met narcolepsie, obstructief slaapapneu / hypopneu syndroom en ploegendienststoornis.
In OSAHS wordt Provigil geïndiceerd als een aanvulling op standaardbehandeling (en) voor de onderliggende obstructie. Als continue positieve luchtwegdruk (CPAP) de voorkeursbehandeling is voor een patiënt, moet een maximale inspanning worden geleverd om gedurende een voldoende lange periode met CPAP te behandelen voordat Provigil wordt gestart. Als Provigil adjunctief wordt gebruikt met CPAP, is aanmoediging en periodieke beoordeling van de naleving van CPAP noodzakelijk.
In alle gevallen is zorgvuldige aandacht voor de diagnose en behandeling van de onderliggende slaapstoornis (en) van het grootste belang. Voorschrijvers moeten zich ervan bewust zijn dat sommige patiënten meer dan één slaapstoornis hebben die bijdraagt aan hun overmatige slaperigheid.
De effectiviteit van modafinil bij langdurig gebruik (meer dan 9 weken in klinische onderzoeken met Narcolepsie en 12 weken in OSAHS en SWSD klinische onderzoeken) is niet systematisch geëvalueerd in placebogecontroleerd trials. De arts die ervoor kiest Provigil voor langere tijd voor te schrijven bij patiënten met Narcolepsie, OSAHS of SWSD, moet de bruikbaarheid op lange termijn voor de individuele patiënt periodiek opnieuw evalueren.
top
Contra
Provigil is gecontra-indiceerd bij patiënten met bekende overgevoeligheid voor modafinil, armodafinil of de inactieve ingrediënten.
top
waarschuwingen
Ernstige uitslag, waaronder het syndroom van Stevens-Johnson
Ernstige uitslag die ziekenhuisopname en stopzetting van de behandeling vereist is, is gemeld bij volwassenen en kinderen in verband met het gebruik van modafinil.
Modafinil is niet goedgekeurd voor gebruik bij pediatrische patiënten voor enige indicatie.
In klinische onderzoeken met modafinil was de incidentie van huiduitslag resulterend in stopzetting ongeveer 0,8% (13 per 1.585) bij pediatrische patiënten (leeftijd <17 jaar); deze uitslag omvatte 1 geval van mogelijk Stevens-Johnson-syndroom (SJS) en 1 geval van duidelijke multi-orgaanovergevoeligheidsreactie. Verschillende van de gevallen waren geassocieerd met koorts en andere afwijkingen (bijv. Braken, leukopenie). De mediane tijd tot uitslag die resulteerde in stopzetting was 13 dagen. Dergelijke gevallen werden niet waargenomen bij 380 pediatrische patiënten die placebo kregen. Er zijn geen ernstige huiduitslag gemeld in volwassen klinische onderzoeken (0 per 4.264) van modafinil.
Zeldzame gevallen van ernstige of levensbedreigende uitslag, waaronder SJS, toxische epidermale necrolyse (TEN) en medicijnuitslag met Eosinofilie en systemische symptomen (DRESS) zijn gemeld bij volwassenen en kinderen in wereldwijde post-marketing ervaring. Het rapportagepercentage van TEN en SJS in verband met het gebruik van modafinil, dat algemeen wordt aanvaard als een onderschatting vanwege onderrapportage, overschrijdt het achtergrondincidentiepercentage. Schattingen van de achtergrondincidentie voor deze ernstige huidreacties in de algemene populatie variëren van 1 tot 2 gevallen per miljoen persoonsjaren.
Er zijn geen factoren bekend waarvan bekend is dat ze het risico op voorkomen of de ernst van huiduitslag geassocieerd met modafinil voorspellen. Bijna alle gevallen van ernstige uitslag geassocieerd met modafinil traden op binnen 1 tot 5 weken na het begin van de behandeling. Geïsoleerde gevallen zijn echter gemeld na langdurige behandeling (bijvoorbeeld 3 maanden). Dienovereenkomstig kan de duur van de therapie niet worden ingeroepen als een middel om het potentiële risico te voorspellen dat wordt ingeluid door de eerste verschijning van uitslag.
Hoewel goedaardige huiduitslag ook optreedt met modafinil, is het niet mogelijk om op betrouwbare wijze te voorspellen welke huiduitslag ernstig zal blijken te zijn. Dienovereenkomstig moet modafinil gewoonlijk worden stopgezet bij het eerste teken van uitslag, tenzij de uitslag duidelijk niet aan drugs gerelateerd is. Stopzetting van de behandeling kan niet voorkomen dat uitslag levensbedreigend wordt of permanent wordt uitgeschakeld of verminkt.
Angio-oedeem en anafylactoïde reacties
Eén ernstig geval van angio-oedeem en één geval van overgevoeligheid (met uitslag, dysfagie en bronchospasme) waren: waargenomen bij 1.595 patiënten behandeld met armodafinil, de R-enantiomeer van modafinil (dat is de racemische mengsel). Dergelijke gevallen werden niet waargenomen in klinische proeven met modafinil. Angio-oedeem is echter gemeld tijdens postmarketingervaring met modafinil. Patiënten moeten worden geadviseerd om de therapie te staken en onmiddellijk tekenen aan hun arts te melden of symptomen die wijzen op angio-oedeem of anafylaxie (bijv. zwelling van gezicht, ogen, lippen, tong of strottenhoofd; moeite met slikken of ademen; heesheid).
Multi-overgevoeligheidsreacties
Multi-orgaanovergevoeligheidsreacties, waaronder ten minste één fataliteit tijdens postmarketingervaring, hebben trad op in nauwe tijdelijke associatie (mediane tijd tot detectie 13 dagen: bereik 4-33) tot de start van modafinil.
Hoewel er een beperkt aantal meldingen is geweest, kunnen overgevoeligheidsreacties met meerdere organen ziekenhuisopname of levensbedreigend zijn. Er zijn geen factoren bekend waarvan bekend is dat ze het risico op voorkomen of de ernst van multi-orgaanovergevoeligheidsreacties geassocieerd met modafinil voorspellen. Tekenen en symptomen van deze aandoening waren divers; echter, patiënten, meestal, hoewel niet exclusief, gepresenteerd met koorts en uitslag geassocieerd met andere betrokkenheid van orgaansystemen. Andere bijbehorende manifestaties waren myocarditis, hepatitis, afwijkingen in de leverfunctietest, hematologische afwijkingen (bijv. eosinofilie, leukopenie, trombocytopenie), jeuk en asthenie. Omdat multi-orgaanovergevoeligheid variabel is in zijn expressie, kunnen andere orgaansysteem symptomen en tekenen, die hier niet worden opgemerkt, optreden.
Als een multi-orgaanovergevoeligheidsreactie wordt vermoed, moet Provigil worden stopgezet. Hoewel er geen casusrapporten zijn die wijzen op kruisgevoeligheid met andere geneesmiddelen die dit syndroom produceren, de ervaring met geneesmiddelen geassocieerd met multi-orgaanovergevoeligheid zou erop wijzen dat dit een mogelijkheid.
Aanhoudende slaperigheid
Patiënten met abnormale slaperigheidsniveaus die Provigil gebruiken, moeten erop worden gewezen dat hun wakkerheidsniveau mogelijk niet weer normaal wordt. Patiënten met overmatige slaperigheid, inclusief degenen die Provigil gebruiken, moeten regelmatig opnieuw worden beoordeeld op hun mate van slaperigheid en, in voorkomend geval, geadviseerd om autorijden of andere potentieel gevaarlijke activiteiten te vermijden. Voorschrijvers moeten zich er ook van bewust zijn dat patiënten slaperigheid of slaperigheid niet erkennen totdat ze tijdens specifieke activiteiten rechtstreeks worden ondervraagd over slaperigheid of slaperigheid.
Psychiatrische symptomen
Psychiatrische bijwerkingen zijn gemeld bij patiënten die met modafinil werden behandeld. Bijwerkingen na het in de handel brengen geassocieerd met het gebruik van modafinil omvatten manie, wanen, hallucinaties, zelfmoordgedachten en agressie, sommige resulterend in ziekenhuisopname. Veel, maar niet alle, patiënten hadden een eerdere psychiatrische geschiedenis. Eén gezonde mannelijke vrijwilliger ontwikkelde ideeën voor referentie, paranoïde wanen en auditieve hallucinaties in combinatie met meerdere dagelijkse doses van 600 mg modafinil en slaapgebrek. Er was geen bewijs van psychose 36 uur na stopzetting van het geneesmiddel.
In de database met gecontroleerde modafinil-onderzoeken voor volwassenen, psychiatrische symptomen resulterend in stopzetting van de behandeling (met een frequentie> 0,3%) en vaker gemeld bij patiënten behandeld met modafinil vergeleken met die behandeld met placebo waren angst (1%), nervositeit (1%), slapeloosheid (<1%), verwarring (<1%), agitatie (<1%) en depressie (<1%). Voorzichtigheid is geboden wanneer Provigil wordt gegeven aan patiënten met een voorgeschiedenis van psychose, depressie of manie. Er moet rekening worden gehouden met de mogelijke opkomst of verergering van psychiatrische symptomen bij patiënten die worden behandeld met Provigil. Als zich psychiatrische symptomen ontwikkelen in combinatie met de toediening van Provigil, overweeg dan om Provigil te staken.
top
Voorzorgsmaatregelen
Diagnose van slaapstoornissen
Provigil mag alleen worden gebruikt bij patiënten die een volledige evaluatie van hun overmatige slaperigheid hebben gehad en bij wie diagnose van narcolepsie, OSAHS en / of SWSD is gesteld in overeenstemming met ICSD of DSM diagnostische criteria (zie Klinische paden). Een dergelijke evaluatie bestaat meestal uit een volledige geschiedenis en lichamelijk onderzoek en kan worden aangevuld met testen in een laboratoriumomgeving. Sommige patiënten kunnen meer dan één slaapstoornis hebben die bijdraagt aan hun overmatige slaperigheid (bijv. OSAHS en SWSD samenvallen bij dezelfde patiënt).
Algemeen
Hoewel niet is aangetoond dat modafinil functionele beperkingen veroorzaakt, kan elk geneesmiddel dat het CZS beïnvloedt, het oordeel, het denken of de motorische vaardigheden beïnvloeden. Patiënten moeten worden gewaarschuwd over het bedienen van een auto of andere gevaarlijke machines totdat ze zijn redelijk zeker dat de behandeling met Provigil geen nadelige invloed zal hebben op hun vermogen om hieraan deel te nemen activiteiten.
CPAP-gebruik bij patiënten met OSAHS
In OSAHS wordt Provigil geïndiceerd als een aanvulling op standaardbehandeling (en) voor de onderliggende obstructie. Als continue positieve luchtwegdruk (CPAP) de voorkeursbehandeling is voor een patiënt, moet een maximale inspanning worden geleverd om gedurende een voldoende lange periode met CPAP te behandelen voordat Provigil wordt gestart. Als Provigil adjunctief wordt gebruikt met CPAP, is aanmoediging en periodieke beoordeling van de naleving van CPAP noodzakelijk.
Cardiovasculair systeem
Modafinil is niet geëvalueerd bij patiënten met een recente geschiedenis van een hartinfarct of instabiele angina en dergelijke patiënten moeten met voorzichtigheid worden behandeld.
In klinische studies van Provigil, tekenen en symptomen, waaronder pijn op de borst, hartkloppingen, kortademigheid en voorbijgaande ischemische T-golfveranderingen op ECG werden waargenomen bij drie personen in associatie met mitralisklepprolaps of linkerventrikel hypertrofie. Het wordt aanbevolen Provigil-tabletten niet te gebruiken bij patiënten met een voorgeschiedenis van linkerventrikelhypertrofie of bij patiënten met mitralisklepprolaps die het mitralisklepprolaps syndroom hebben ervaren wanneer ze eerder CNS kregen stimulerende middelen. Dergelijke symptomen kunnen omvatten, maar zijn niet beperkt tot, ischemische ECG-veranderingen, pijn op de borst of aritmie. Overweeg cardiale evaluatie als een van deze symptomen zich opnieuw voordoet.
Bloeddrukmeting in gecontroleerde kortetermijnonderzoeken (<3 maanden) toonde geen klinisch significante resultaten veranderingen in gemiddelde systolische en diastolische bloeddruk bij patiënten die Provigil krijgen in vergelijking met placebo. Echter, een retrospectieve analyse van het gebruik van antihypertensiva in deze studies toonde aan dat een groter deel van patiënten op Provigil hadden nieuw of verhoogd gebruik van antihypertensiva nodig (2,4%) vergeleken met patiënten die placebo kregen (0,7%). Het differentiële gebruik was iets groter wanneer alleen studies in OSAHS werden opgenomen, met 3,4% van de patiënten op Provigil en 1,1% van de patiënten die placebo kregen en dergelijke wijzigingen nodig hadden in het gebruik van antihypertensiva medicatie. Een verhoogde controle van de bloeddruk kan geschikt zijn bij patiënten die Provigil gebruiken.
Patiënten die steroïde anticonceptiva gebruiken
De werkzaamheid van steroïde anticonceptiva kan verminderd zijn bij gebruik met Provigil tabletten en gedurende één maand na stopzetting van de behandeling (zie Voorzorgsmaatregelen, Interacties tussen geneesmiddelen). Alternatieve of gelijktijdige anticonceptiemethoden worden aanbevolen voor patiënten die worden behandeld met Provigil-tabletten en gedurende één maand na stopzetting van Provigil.
Patiënten die cyclosporine gebruiken
De bloedspiegels van cyclosporine kunnen worden verlaagd bij gebruik met Provigil (zie Voorzorgsmaatregelen, Interacties tussen geneesmiddelen). Controle van circulerende cyclosporine-concentraties en een geschikte dosisaanpassing voor cyclosporine moeten worden overwogen wanneer deze geneesmiddelen gelijktijdig worden gebruikt.
Patiënten met ernstige leverinsufficiëntie
Bij patiënten met ernstige leverinsufficiëntie, met of zonder cirrose (zie Klinische Farmacologie), Provigil moet in een lagere dosis worden toegediend (zie Dosering en administratie).
Patiënten met ernstige nierinsufficiëntie
Er is onvoldoende informatie om de veiligheid en werkzaamheid van de dosering te bepalen bij patiënten met ernstige nierinsufficiëntie. (Zie voor farmacokinetiek bij nierinsufficiëntie Klinische Farmacologie.)
Oudere patiënten
Bij oudere patiënten kan de eliminatie van modafinil en zijn metabolieten verminderd zijn als gevolg van veroudering. Daarom moet het gebruik van lagere doses bij deze populatie worden overwogen. (Zien Klinische Farmacologie en Dosering en administratie).
Informatie voor patiënten
Artsen wordt geadviseerd om de volgende kwesties te bespreken met patiënten voor wie zij Provigil voorschrijven.
Provigil is geïndiceerd voor patiënten met abnormale slaperigheid. Het is aangetoond dat Provigil deze abnormale neiging om in slaap te vallen verbetert, maar niet wegneemt. Daarom mogen patiënten hun eerdere gedrag met betrekking tot mogelijk gevaarlijke activiteiten (bijv. Autorijden, het bedienen van machines) of andere niet wijzigen activiteiten die passende niveaus van waakzaamheid vereisen, totdat en tenzij is aangetoond dat behandeling met Provigil niveaus van waakzaamheid produceert die een dergelijke activiteiten. Patiënten moeten erop worden gewezen dat Provigil geen vervanging is voor slaap.
Patiënten moeten worden geïnformeerd dat het van cruciaal belang kan zijn dat ze hun eerder voorgeschreven behandelingen blijven nemen (patiënten met OSAHS die CPAP krijgen, moeten dit bijvoorbeeld blijven doen).
Patiënten moeten worden geïnformeerd over de beschikbaarheid van een bijsluiter voor de patiënt en moeten worden geïnstrueerd om de bijsluiter te lezen alvorens Provigil in te nemen.
Patiënten moeten worden geadviseerd om contact op te nemen met hun arts als ze pijn op de borst, uitslag, angst, of tekenen van psychose of manie ervaren.
Zwangerschap
Patiënten moeten worden geadviseerd om hun arts op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de therapie. Patiënten moeten worden gewaarschuwd met betrekking tot het mogelijk verhoogde risico op zwangerschap bij het gebruik van steroïde anticonceptiva (inclusief depot of implanteerbaar) voorbehoedsmiddelen) met Provigil en gedurende één maand na stopzetting van de behandeling (zie carcinogenese, mutagenese, verminderde vruchtbaarheid en Zwangerschap).
verpleging
Patiënten moeten worden geadviseerd om hun arts op de hoogte te stellen als zij een baby borstvoeding geven.
Gelijktijdige medicatie
Patiënten moeten worden geadviseerd om hun arts te informeren als ze iets nemen of van plan zijn te nemen geneesmiddelen op recept of zonder recept verkrijgbaar zijn, vanwege het potentieel voor interacties tussen Provigil en andere medicijnen.
Alcohol
Patiënten moeten erop worden gewezen dat het gebruik van Provigil in combinatie met alcohol niet is onderzocht. Patiënten moeten erop worden gewezen dat het verstandig is om alcohol te vermijden tijdens het gebruik van Provigil.
Allergische reacties
Patiënten moeten het advies krijgen om te stoppen met Provigil en hun arts op de hoogte te stellen als ze uitslag krijgen, netelroos, zweertjes in de mond, blaren, schilferende huid, slikproblemen of ademhaling of een gerelateerde allergie fenomeen.
Geneesmiddelinteracties
CNS actieve medicijnen
methylfenidaat
In een onderzoek met een enkele dosis bij gezonde vrijwilligers, gelijktijdige toediening van modafinil (200 mg) met methylfenidaat (40 mg) veroorzaakte geen significante veranderingen in de farmacokinetiek van beide drug. De absorptie van Provigil kan echter worden vertraagd met ongeveer een uur bij gelijktijdige toediening met methylfenidaat.
In een steady-state-onderzoek met meerdere doses bij gezonde vrijwilligers werd modafinil eenmaal daags toegediend met 200 mg / dag gedurende 7 dagen gevolgd door 400 mg / dag gedurende 21 dagen. Toediening van methylfenidaat (20 mg / dag) gedurende dagen 22-28 van de behandeling met modafinil 8 uur daarna de dagelijkse dosis modafinil veroorzaakte geen significante wijzigingen in de farmacokinetiek van modafinil.
dextroamfetamine
In een onderzoek met een enkele dosis bij gezonde vrijwilligers, gelijktijdige toediening van modafinil (200 mg) met dextroamfetamine (10 mg) veroorzaakte geen significante veranderingen in de farmacokinetiek van beide drug. De absorptie van Provigil kan echter worden vertraagd met ongeveer een uur bij gelijktijdige toediening met dextroamfetamine.
In een steady-state-onderzoek met meerdere doses bij gezonde vrijwilligers werd modafinil eenmaal daags toegediend met 200 mg / dag gedurende 7 dagen gevolgd door 400 mg / dag gedurende 21 dagen. Toediening van dextroamfetamine (20 mg / dag) gedurende dagen 22-28 van de behandeling met modafinil 7 uur na de dagelijkse dosis modafinil veroorzaakte geen significante wijzigingen in de farmacokinetiek van modafinil.
clomipramine
Gelijktijdige toediening van een enkele dosis clomipramine (50 mg) op de eerste van drie dagen van behandeling met modafinil (200 mg / dag) bij gezonde vrijwilligers vertoonde geen effect op de farmacokinetiek van beide geneesmiddelen. Een incident met verhoogde niveaus van clomipramine en zijn actieve metaboliet desmethylclomipramine is echter gemeld bij een patiënt met narcolepsie tijdens de behandeling met modafinil.
triazolam
In het geneesmiddelinteractiestudie tussen Provigil en ethinylestradiol (EE2), op dezelfde dagen als die voor de plasmabemonstering voor EE2-farmacokinetiek, werd ook een enkele dosis triazolam (0,125 mg) toegediend. De gemiddelde Cmax en AUC0-β van triazolam waren met respectievelijk 42% en 59% afgenomen en de eliminatiehalfwaardetijd was met ongeveer een uur na de modafinil-behandeling verminderd.
Monoamine Oxidase (MAO) -remmers
Er zijn geen interactiestudies met monoamine-oxidaseremmers uitgevoerd. Daarom is voorzichtigheid geboden bij gelijktijdige toediening van MAO-remmers en modafinil.
Andere medicijnen
warfarine
Er waren geen significante veranderingen in de farmacokinetische profielen van R- en S-warfarine bij gezonde proefpersonen die een enkele dosis racemisch warfarine kregen (5 mg) na chronische toediening van modafinil (200 mg / dag gedurende 7 dagen gevolgd door 400 mg / dag gedurende 27 dagen) ten opzichte van de profielen bij proefpersonen placebo. Frequentere monitoring van protrombinetijden / INR is echter raadzaam wanneer Provigil gelijktijdig wordt toegediend met warfarine (zie Klinische Farmacologie, Farmacokinetiek, interacties tussen geneesmiddelen).
Ethinylestradiol
Toediening van modafinil aan vrouwelijke vrijwilligers eenmaal daags gedurende 7 dagen met 200 mg / dag gevolgd door 400 mg / dag gedurende 21 dagen resulteerde in een gemiddelde afname van 11% in Cmax en een afname van 18% in AUC0-24 van ethinyloestradiol (EE2; 0,035 mg; oraal toegediend met norgestimate). Er was geen duidelijke verandering in de eliminatiesnelheid van ethinyloestradiol.
cyclosporine
Eén geval van een interactie tussen modafinil en cyclosporine, een substraat van CYP3A4, is gemeld bij een 41-jarige vrouw die een orgaantransplantatie had ondergaan. Na een maand toediening van 200 mg modafinil werden de bloedspiegels van cyclosporine met 50% verlaagd. De interactie werd verondersteld te wijten te zijn aan het verhoogde metabolisme van cyclosporine, aangezien geen andere factor die naar verwachting de dispositie van het geneesmiddel zou beïnvloeden, was veranderd. Een dosisaanpassing voor cyclosporine kan nodig zijn.
Mogelijke interacties met geneesmiddelen die cytochroom P-450 iso-enzymen en andere leverenzymen remmen, induceren of metaboliseren
In in vitro-onderzoeken met primaire humane hepatocytenkweken bleek modafinil CYP1A2, CYP2B6 en CYP3A4 enigszins te induceren op een concentratieafhankelijke manier. Hoewel inductieresultaten op basis van in vitro experimenten niet noodzakelijk voorspellend zijn voor de respons in vivo, wees voorzichtig moet worden uitgeoefend wanneer Provigil gelijktijdig wordt toegediend met geneesmiddelen die afhankelijk zijn van deze drie enzymen klaring. In het bijzonder kunnen lagere bloedspiegels van dergelijke geneesmiddelen het gevolg zijn (zie andere geneesmiddelen, Cyclosporineabove).
De blootstelling van menselijke hepatocyten aan modafinil in vitro produceerde een schijnbare concentratiegerelateerde onderdrukking van expressie van CYP2C9-activiteit wat suggereert dat er een potentieel is voor een metabole interactie tussen modafinil en de substraten van dit enzym (bijvoorbeeld S-warfarine en fenytoïne). In een volgend klinisch onderzoek bij gezonde vrijwilligers toonde chronische behandeling met modafinil geen significant effect op de farmacokinetiek van warfarine in één dosis vergeleken met placebo (zie Voorzorgsmaatregelen, Drug Interactions, Warfarin).
In vitro studies met menselijke levermicrosomen toonden aan dat modafinil CYP2C19 reversibel remde bij farmacologisch relevante concentraties van modafinil. CYP2C19 wordt ook omkeerbaar geremd, met vergelijkbare potentie, door een circulerende metaboliet, modafinil sulfon. Hoewel de maximale plasmaconcentraties van modafinilsulfon veel lager zijn dan die van de ouder modafinil, zou het gecombineerde effect van beide verbindingen langdurige gedeeltelijke remming van de kunnen veroorzaken enzym. Geneesmiddelen die grotendeels worden geëlimineerd via CYP2C19-metabolisme, zoals diazepam, propranolol, fenytoïne (ook via CYP2C9) of S-mefenytoïne kan een verlengde eliminatie hebben bij gelijktijdige toediening met Provigil en kan dosisreductie en monitoring vereisen voor toxiciteit.
Tricyclische antidepressiva
CYP2C19 biedt ook een ondersteunende route voor het metabolisme van bepaalde tricyclische antidepressiva (bijv. Clomipramine en desipramine) die voornamelijk worden gemetaboliseerd door CYP2D6. Bij met tricyclische behandelde patiënten met een tekort aan CYP2D6 (d.w.z. degenen die slechte metaboliseerders van debrisoquine zijn; 7-10% van de blanke bevolking; vergelijkbaar of lager in andere populaties), kan de hoeveelheid metabolisme door CYP2C19 aanzienlijk worden verhoogd. Provigil kan bij deze subgroep van patiënten een verhoging van de tricyclische niveaus veroorzaken. Artsen moeten zich ervan bewust zijn dat een verlaging van de dosis tricyclische middelen nodig kan zijn bij deze patiënten.
Vanwege de gedeeltelijke betrokkenheid van CYP3A4 bij de metabole eliminatie van modafinil, bovendien gelijktijdige toediening van krachtige inductoren van CYP3A4 (bijv. carbamazepine, fenobarbital, rifampin) of CYP3A4-remmers (bijv. ketoconazol, itraconazol) kunnen de plasmaconcentraties van modafinil.
Carcinogenese, mutagenese, aantasting van de vruchtbaarheid
carcinogenese
Carcinogeniteitsstudies werden uitgevoerd waarbij modafinil gedurende 78 weken aan muizen werd toegediend en 104 weken aan ratten in doses van 6, 30 en 60 mg / kg / dag. De hoogste bestudeerde dosis is 1,5 (muis) of 3 (rat) maal groter dan de aanbevolen dagelijkse dosis voor volwassenen modafinil (200 mg) op basis van mg / m2. Er waren geen aanwijzingen voor tumorigenese geassocieerd met toediening van modafinil in deze studies. Omdat het muizenonderzoek echter een onvoldoende hoge dosis gebruikte die niet representatief was voor een maximaal getolereerde dosis, werd een daaropvolgend carcinogeniteitsonderzoek uitgevoerd in de Tg. AC transgene muis. Doses geëvalueerd in de Tg. AC-test was 125, 250 en 500 mg / kg / dag, dermaal toegediend. Er waren geen aanwijzingen voor tumorigeniciteit geassocieerd met toediening van modafinil; dit dermale model kan echter niet voldoende het carcinogene potentieel van een oraal toegediend geneesmiddel beoordelen.
mutagenese
Modafinil vertoonde geen bewijs van mutageen of clastogeen potentieel in een reeks in vitro (d.w.z. bacteriële reverse mutation assay, muis-lymfoomtk-assay, chromosomale aberratie assay in humane lymfocyten, celtransformatie assay in BALB / 3T3 muizenembryocellen) assays in de afwezigheid of aanwezigheid van metabole activering, of in vivo (muizenbeenmerg micronucleus) assays. Modafinil was ook negatief in de niet-geplande DNA-synthesetest bij hepatocyten van ratten.
Aantasting van de vruchtbaarheid
Orale toediening van modafinil (doses tot 480 mg / kg / dag) aan mannelijke en vrouwelijke ratten voorafgaand aan en tijdens paren en doorgaan bij vrouwen tot en met dag 7 van de zwangerschap veroorzaakte een toename van de tijd om op het hoogste niveau te paren dosis; er werden geen effecten waargenomen op andere vruchtbaarheid of reproductieve parameters. De dosis zonder effect van 240 mg / kg / dag was geassocieerd met een plasmamodafinilblootstelling (AUC) die ongeveer gelijk was aan die bij mensen bij de aanbevolen dosis van 200 mg.
Zwangerschap
Zwangerschap Categorie C:
In onderzoeken bij ratten en konijnen werd ontwikkelingstoxiciteit waargenomen bij klinisch relevante blootstellingen.
Modafinil (50, 100 of 200 mg / kg / dag) oraal toegediend aan zwangere ratten gedurende de periode van veroorzaakte organogenese, in afwezigheid van maternale toxiciteit, een toename van resorpties en een verhoogde incidentie van viscerale en skeletvariaties bij de nakomelingen op de hoogste dosis. De hogere dosis zonder effect voor embryofoetale ontwikkelingstoxiciteit bij ratten werd geassocieerd met een plasma modafinil blootstelling ongeveer 0,5 maal de AUC bij mensen bij de aanbevolen dagelijkse dosis (RHD) van 200 mg. In een volgend onderzoek tot 480 mg / kg / dag (blootstelling aan plasmamodafinil bij benadering 2 keer de AUC bij mensen bij de RHD) werden echter geen nadelige effecten op de ontwikkeling van het embryofetaal waargenomen.
Modafinil oraal toegediend aan zwangere konijnen gedurende de periode van organogenese in doses van 45, 90 en 180 mg / kg / dag verhoogde de incidentie van structurele veranderingen van de foetus en embryofoetale sterfte bij de hoogste dosis. De hoogste dosis zonder effect voor ontwikkelingstoxiciteit was geassocieerd met een AUC van plasmamodafinil die ongeveer gelijk was aan de AUC bij mensen bij de RHD.
Orale toediening van armodafinil (het R-enantiomeer van modafinil; 60, 200 of 600 mg / kg / dag) aan zwangere ratten gedurende de periode van organogenese resulteerde in verhoogde incidentie van foetale viscerale en skeletvariaties bij de tussenliggende dosis of hoger en verminderde foetale lichaamsgewichten op het hoogste dosis. De dosis zonder effect voor embryofoetale ontwikkelingstoxiciteit bij ratten was geassocieerd met een plasma armodafinil blootstelling (AUC) ongeveer een tiende maal de AUC voor armodafinil bij mensen behandeld met modafinil bij de RHD.
Toediening van Modafinil aan ratten tijdens dracht en lactatie bij orale doses tot 200 mg / kg / dag resulteerde in verminderde levensvatbaarheid bij de nakomelingen bij doses hoger dan 20 mg / kg / dag (AUC van plasmamodafinil ongeveer 0,1 maal de AUC bij mensen bij de RHD). Er werden geen effecten op postnatale ontwikkelings- en neuro-gedragsparameters waargenomen bij overlevende nakomelingen.
Er zijn geen adequate en goed gecontroleerde studies bij zwangere vrouwen. Twee gevallen van intra-uteriene groeiachterstand en één geval van spontane abortus zijn gemeld in samenhang met armodafinil en modafinil. Hoewel de farmacologie van modafinil en armodafinil niet identiek is aan die van de sympathomimetische amines, hebben ze wel enkele farmacologische eigenschappen met deze klasse. Bepaalde van deze geneesmiddelen zijn in verband gebracht met intra-uteriene groeiachterstand en spontane abortussen. Of de gemelde gevallen drugsgerelateerd zijn, is onbekend.
Modafinil mag alleen tijdens de zwangerschap worden gebruikt als het potentiële voordeel het potentiële risico voor de foetus rechtvaardigt.
Bevalling
Het effect van modafinil op arbeid en bevalling bij mensen is niet systematisch onderzocht.
Moeders die borstvoeding geven
Het is niet bekend of modafinil of zijn metabolieten worden uitgescheiden in moedermelk. Omdat veel geneesmiddelen in moedermelk worden uitgescheiden, is voorzichtigheid geboden wanneer Provigil-tabletten worden toegediend aan een vrouw die borstvoeding geeft.
Gebruik bij kinderen
Veiligheid en effectiviteit bij pediatrische patiënten jonger dan 16 jaar zijn niet vastgesteld. Ernstige huiduitslag, waaronder erythema multiforme major (EMM) en Stevens-Johnson-syndroom (SJS) zijn in verband gebracht met het gebruik van modafinil bij pediatrische patiënten (zie waarschuwingen, Ernstige uitslag, waaronder het syndroom van Stevens-Johnson).
In een gecontroleerd 6 weken durend onderzoek werden 165 pediatrische patiënten (5-17 jaar) met narcolepsie behandeld met modafinil (n = 123) of placebo (n = 42). Er waren geen statistisch significante verschillen ten gunste van modafinil ten opzichte van placebo bij het verlengen van slaaplatentie als gemeten door MSLT, of in percepties van slaperigheid zoals bepaald door de klinische globale indruk-clinician schaal (CGI-C).
In de gecontroleerde en open-label klinische studies, behandelingsgerelateerde bijwerkingen van het psychiatrische en zenuwstelsel inclusief Tourette-syndroom, slapeloosheid, vijandigheid, verhoogde kataplexie, verhoogde hypnagogische hallucinaties en suïcidale ideevorming. Voorbijgaande leukopenie, die zonder medische interventie oploste, werd ook waargenomen. In het gecontroleerde klinische onderzoek ondervonden 3 van 38 meisjes van 12 jaar of ouder, behandeld met modafinil, dysmenorroe vergeleken met 0 van 10 meisjes die placebo kregen.
Geriatrisch gebruik
Veiligheid en effectiviteit bij personen ouder dan 65 jaar zijn niet vastgesteld. Ervaring met een beperkt aantal patiënten die ouder waren dan 65 jaar in klinische onderzoeken toonde een incidentie van bijwerkingen vergelijkbaar met andere leeftijdsgroepen.
top
Bijwerkingen
Modafinil is geëvalueerd op veiligheid bij meer dan 3500 patiënten, van wie meer dan 2000 patiënten met overmatige slaperigheid geassocieerd met primaire slaapstoornissen en waakzaamheid kregen ten minste één dosis van modafinil. In klinische onderzoeken is gebleken dat modafinil over het algemeen goed wordt verdragen en dat de meeste bijwerkingen mild tot matig waren.
De meest voorkomende bijwerkingen (â ‰ ¥ 5%) geassocieerd met het gebruik van Provigil vaker dan met placebo behandelde patiënten bij de placebo-gecontroleerde klinische studies bij primaire slaap- en waakstoornissen waren hoofdpijn, misselijkheid, nervositeit, rhinitis, diarree, rugpijn, angst, slapeloosheid, duizeligheid en dyspepsie. Het bijwerkingenprofiel was vergelijkbaar in deze studies.
In de placebogecontroleerde klinische onderzoeken stopten 74 van de 934 patiënten (8%) die Provigil ontvingen vanwege een negatieve ervaring, vergeleken met 3% van de patiënten die placebo kregen. De meest voorkomende redenen voor stopzetting kwamen vaker voor bij Provigil dan bij placebo patiënten waren hoofdpijn (2%), misselijkheid, angst, duizeligheid, slapeloosheid, pijn op de borst en nervositeit (elk <1%). In een Canadese klinische proef, een 35-jarige zwaarlijvige narcoleptische man met een voorgeschiedenis van syncopale afleveringen ervoer een aflevering van asystolie van 9 seconden na 27 dagen behandeling met modafinil (verdeeld in 300 mg / dag) doses).
Incidentie in gecontroleerde onderzoeken
De volgende tabel (tabel 3) geeft de bijwerkingen weer die plaatsvonden met een snelheid van 1% of meer en kwamen vaker voor bij volwassen patiënten die met Provigil worden behandeld dan bij met placebo behandelde patiënten in de voornaamste, placebo-gecontroleerde klinische trials.
De voorschrijver moet zich ervan bewust zijn dat de onderstaande cijfers niet kunnen worden gebruikt om de frequentie van bijwerkingen in het internet te voorspellen gangbare medische praktijk, waarbij patiëntkenmerken en andere factoren kunnen verschillen van die tijdens klinische studies. Evenzo kunnen de aangehaalde frequenties niet direct worden vergeleken met cijfers verkregen uit andere klinische onderzoeken met verschillende behandelingen, toepassingen of onderzoekers. Beoordeling van deze frequenties biedt voorschrijvers echter een basis om de relatieve bijdrage van medicijn- en niet-medicamenteuze factoren aan de incidentie van bijwerkingen in de bestudeerde populatie te schatten.
| Lichaamssysteem | Gewenste termijn | modafinil (n = 934) |
Placebo (n = 567) |
| * Zes dubbelblinde, placebo-gecontroleerde klinische studies in narcolepsie, OSAHS en SWSD. 1 Voorvallen gemeld door minstens 1% van de patiënten die met Provigil werden behandeld en die frequenter waren dan in de placebogroep, zijn opgenomen; incidentie wordt afgerond op de dichtstbijzijnde 1%. De terminologie van de negatieve ervaring wordt gecodeerd met behulp van een standaard gemodificeerd COSTART-woordenboek. Voorvallen waarvoor de Provigil-incidentie ten minste 1% was, maar gelijk aan of minder dan placebo, worden niet in de tabel vermeld. Deze gebeurtenissen omvatten het volgende: infectie, pijn, accidenteel letsel, buikpijn, hypothermie, allergische reactie, asthenie, koorts, virale infectie, nekpijn, migraine, abnormaal elektrocardiogram, hypotensie, tandaandoening, braken, parodontale abces, verhoogde eetlust, ecchymose, hyperglykemie, perifeer oedeem, gewichtsverlies, gewicht winst, spierpijn, krampen in de benen, artritis, kataplexie, abnormaliteit in het denken, slaapstoornis, verhoogde hoest, sinusitis, dyspneu, bronchitis, uitslag, conjunctivitis, oorpijn, dysmenorroe4, urineweginfectie. 2 Verhoogde leverenzymen. 3 Oro-gezichtsdyskinesieën. 4 Incidentie gecorrigeerd voor geslacht. | |||
| Lichaam als een geheel | Hoofdpijn | 34% | 23% |
| Rugpijn | 6% | 5% | |
| Griep syndroom | 4% | 3% | |
| Pijn op de borst | 3% | 1% | |
| Rillingen | 1% | 0% | |
| Nekstijfheid | 1% | 0% | |
| cardiovasculaire | hypertensie | 3% | 1% |
| tachycardie | 2% | 1% | |
| hartklopping | 2% | 1% | |
| vasodilatatie | 2% | 0% | |
| Digestive | Misselijkheid | 11% | 3% |
| Diarree | 6% | 5% | |
| indigestie | 5% | 4% | |
| Droge mond | 4% | 2% | |
| anorexia | 4% | 1% | |
| Constipatie | 2% | 1% | |
| Abnormale leverfunctie2 | 2% | 1% | |
| Winderigheid | 1% | 0% | |
| Mondzweren | 1% | 0% | |
| Dorst | 1% | 0% | |
| Bloed- / Lymfatische | eosinofilie | 1% | 0% |
| Metabolic / Nutritional | zwelling | 1% | 0% |
| Nerveus | Nervositeit | 7% | 3% |
| Slapeloosheid | 5% | 1% | |
| Ongerustheid | 5% | 1% | |
| Duizeligheid | 5% | 4% | |
| Depressie | 2% | 1% | |
| paresthesie | 2% | 0% | |
| Slaperigheid | 2% | 1% | |
| hypertonie | 1% | 0% | |
| dyskinesie3 | 1% | 0% | |
| hyperkinesie | 1% | 0% | |
| Agitatie | 1% | 0% | |
| Verwarring | 1% | 0% | |
| Tremor | 1% | 0% | |
| Emotionele labiliteit | 1% | 0% | |
| Duizeligheid | 1% | 0% | |
| ademhalings | rhinitis | 7% | 6% |
| keelholteontsteking | 4% | 2% | |
| Longaandoening | 2% | 1% | |
| epistaxis | 1% | 0% | |
| Astma | 1% | 0% | |
| Skin / Appendages | Zweten | 1% | 0% |
| Herpes Simplex | 1% | 0% | |
| Speciale zintuigen | amblyopie | 1% | 0% |
| Abnormaal zicht | 1% | 0% | |
| Smaak Perversie | 1% | 0% | |
| Oogpijn | 1% | 0% | |
| Urogenital | Urine abnormaliteit | 1% | 0% |
| hematurie | 1% | 0% | |
| pyurie | 1% | 0% |
Dosisafhankelijkheid van bijwerkingen
In de placebogecontroleerde klinische onderzoeken bij volwassenen waarbij doses van 200, 300 en 400 mg / dag werden vergeleken Provigil en placebo, de enige bijwerkingen die duidelijk dosisgerelateerd waren, waren hoofdpijn en ongerustheid.
Wijzigingen in vitale functies
Hoewel er geen consistente verandering in gemiddelde waarden van hartslag of systolische en diastolische bloeddruk was, was de vereiste voor antihypertensiva was iets groter bij patiënten die Provigil kregen dan bij placebo (zie Voorzorgsmaatregelen).
Gewichtsveranderingen
Er waren geen klinisch significante verschillen in lichaamsgewichtsverandering bij patiënten die werden behandeld met Provigil in vergelijking met met placebo behandelde patiënten in de placebogecontroleerde klinische onderzoeken.
Laboratoriumveranderingen
Klinische chemie, hematologie en urinalyseparameters werden gevolgd in fase 1, 2 en 3 studies. In deze onderzoeken bleken de gemiddelde plasmaspiegels van gamma-glutamyltransferase (GGT) en alkalische fosfatase (AP) hoger te zijn na toediening van Provigil, maar niet placebo. Weinig proefpersonen hadden echter GGT- of AP-verhogingen buiten het normale bereik. Verschuivingen naar hogere, maar niet klinisch significant abnormale, GGT- en AP-waarden leken in de loop van de tijd te stijgen in de populatie die werd behandeld met Provigil in de fase 3 klinische onderzoeken. Er waren geen verschillen zichtbaar in alanineaminotransferase, aspartaataminotransferase, totaal eiwit, albumine of totaal bilirubine.
ECG-wijzigingen
Er werd geen behandelingspatroon van ECG-afwijkingen gevonden in placebogecontroleerde klinische onderzoeken na toediening van Provigil.
Postmarketingrapporten
De volgende bijwerkingen zijn geïdentificeerd tijdens het gebruik van Provigil na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onzekere omvang, is het niet mogelijk om de frequentie ervan betrouwbaar te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen. Besluiten om deze reacties op te nemen in de etikettering zijn meestal gebaseerd op een of meer van de volgende factoren: (1) ernst van de reactie, (2) frequentie van rapportage, of (3) sterkte van causaal verband met Provigil.
Hematologisch: agranulocytose
top
Drugsmisbruik en afhankelijkheid
Gecontroleerde stofklasse
Modafinil (Provigil) is opgenomen in bijlage IV van de Controlled Substances Act.
Misbruikpotentieel en afhankelijkheid
Naast het wakkermakende effect en de verhoogde bewegingsactiviteit bij dieren, bij de mens, produceert Provigil psychoactieve en euforische effecten, stemmingswisselingen, perceptie, denken en gevoelens die typerend zijn voor andere CZS-stimulerende middelen. In in vitro bindende studies bindt modafinil aan de plaats van heropname van dopamine en veroorzaakt een toename van extracellulaire dopamine, maar geen toename van dopamine-afgifte. Modafinil is versterkend, zoals blijkt uit zijn zelftoediening bij apen die eerder zijn getraind om zelf cocaïne toe te dienen. In sommige studies werd modafinil ook gedeeltelijk gediscrimineerd als stimulerend. Artsen moeten patiënten nauwlettend volgen, vooral degenen met een geschiedenis van misbruik van drugs en / of stimulerende middelen (bijvoorbeeld methylfenidaat, amfetamine of cocaïne). Patiënten moeten worden geobserveerd op tekenen van misbruik of misbruik (bijv. Verhoging van doses of gedrag dat drugs zoekt).
Het misbruikpotentieel van modafinil (200, 400 en 800 mg) werd beoordeeld ten opzichte van methylfenidaat (45 en 90 mg) in een intramuraal onderzoek bij personen die ervaring hadden met misbruik van drugs. Resultaten van deze klinische studie toonden aan dat modafinil psychoactieve en euforische effecten en gevoelens produceerde die consistent zijn met andere geplande CZS-stimulerende middelen (methylfenidaat).
het terugtrekken
De effecten van het staken van modafinil werden gemonitord na 9 weken gebruik van modafinil in één Amerikaanse fase 3 gecontroleerde klinische studie. Er werden geen specifieke ontwenningsverschijnselen waargenomen gedurende 14 dagen van observatie, hoewel slaperigheid terugkeerde bij narcoleptische patiënten.
top
overdosering
Menselijke ervaring
In klinische onderzoeken waren in totaal 151 protocolspecifieke doses variërend van 1000 tot 1600 mg / dag (5 tot 8 maal de aanbevolen dagelijkse dosis van 200 mg) zijn toegediend aan 32 proefpersonen, waaronder 13 proefpersonen die gedurende 7 tot 21 opeenvolgende doses van 1000 of 1200 mg / dag ontvingen dagen. Bovendien traden verschillende opzettelijke acute overdoses op; de twee grootste zijn 4500 mg en 4000 mg ingenomen door twee personen die deelnemen aan buitenlandse depressiestudies. Geen van deze proefpersonen ondervond onverwachte of levensbedreigende effecten. Bijwerkingen die werden gemeld bij deze doses omvatten excitatie of agitatie, slapeloosheid en lichte of matige verhogingen van hemodynamische parameters. Andere waargenomen hooggedoseerde effecten in klinische onderzoeken omvatten angst, prikkelbaarheid, agressiviteit, verwardheid, nervositeit, tremor, hartkloppingen, slaapstoornissen, misselijkheid, diarree en verminderde protrombine tijd.
Uit postmarketingervaring zijn er geen meldingen geweest van fatale overdoses met alleen modafinil (doses tot 12 gram). Overdoses met meerdere geneesmiddelen, waaronder modafinil, hebben tot fatale afloop geleid. Symptomen die het vaakst gepaard gaan met een overdosis modafinil, alleen of in combinatie met andere geneesmiddelen, zijn onder meer: slapeloosheid; symptomen van het centrale zenuwstelsel zoals rusteloosheid, desoriëntatie, verwarring, excitatie en hallucinatie; spijsverteringsveranderingen zoals misselijkheid en diarree; en cardiovasculaire veranderingen zoals tachycardie, bradycardie, hypertensie en pijn op de borst.
Gevallen van accidentele ingestie / overdosis zijn gemeld bij kinderen vanaf 11 maanden oud. De hoogste gerapporteerde accidentele inname op basis van mg / kg vond plaats bij een driejarige jongen die 800-1000 mg (50-63 mg / kg) modafinil had ingenomen. Het kind bleef stabiel. De symptomen geassocieerd met overdosis bij kinderen waren vergelijkbaar met die waargenomen bij volwassenen.
Beheer van overdoses
Tot op heden is geen specifiek antidotum voor de toxische effecten van overdosering met modafinil vastgesteld. Dergelijke overdoses moeten worden behandeld met primair ondersteunende zorg, inclusief cardiovasculaire monitoring. Als er geen contra-indicaties zijn, moet geïnduceerde braken of maagspoeling worden overwogen. Er zijn geen gegevens die wijzen op het nut van dialyse of verzuring van urine of alkalisatie bij het verbeteren van de eliminatie van geneesmiddelen. De arts moet overwegen contact op te nemen met een gifcentrum voor de behandeling van een overdosis.
top
Dosering en administratie
De aanbevolen dosis Provigil is 200 mg eenmaal daags.
Voor patiënten met narcolepsie en OSAHS moet Provigil 's morgens als een enkele dosis worden ingenomen.
Voor patiënten met SWSD moet Provigil ongeveer 1 uur vóór het begin van hun dienst worden ingenomen.
Doses tot 400 mg / dag, gegeven als een enkele dosis, worden goed verdragen, maar er is geen consistent bewijs dat deze dosis een bijkomend voordeel biedt dat groter is dan de dosis van 200 mg (zie Klinische Farmacologie en Klinische paden).
Algemene Overwegingen
Aanpassing van de dosering moet worden overwogen voor gelijktijdige medicijnen die substraten zijn voor CYP3A4, zoals triazolam en cyclosporine (zie Voorzorgsmaatregelen, Interacties tussen geneesmiddelen).
Geneesmiddelen die grotendeels worden geëlimineerd via CYP2C19-metabolisme, zoals diazepam, propranolol, fenytoïne (ook via CYP2C9) of S-mefenytoïne kan een verlengde eliminatie hebben bij gelijktijdige toediening met Provigil en kan dosisreductie en monitoring vereisen voor toxiciteit.
Bij patiënten met ernstige leverinsufficiëntie moet de dosis Provigil worden verlaagd tot de helft van de aanbevolen dosis voor patiënten met een normale leverfunctie (zie CKlinische Farmacologie en Voorzorgsmaatregelen).
Er is onvoldoende informatie om de veiligheid en werkzaamheid van de dosering te bepalen bij patiënten met ernstige nierinsufficiëntie (zie Klinische Farmacologie en Voorzorgsmaatregelen).
Bij oudere patiënten kan de eliminatie van Provigil en zijn metabolieten worden verminderd als gevolg van veroudering. Daarom moet het gebruik van lagere doses bij deze populatie worden overwogen (zie Klinische Farmacologie en Voorzorgsmaatregelen).
top
Hoe geleverd
Provigil® (modafinil) tabletten
100 mg: elke capsulevormige, witte, niet-omhulde tablet is aan de ene kant gemerkt met "Provigil" en aan de andere kant "100 MG".
NDC 63459-101-01 - Flessen van 100
200 mg: Elke capsulevormige, witte, ingesneden, niet-omhulde tablet heeft de inscriptie "Provigil" aan de ene zijde en "200 MG" aan de andere zijde.
NDC 63459-201-01 - Flessen van 100
Bewaren bij 20 ° - 25 ° C (68 ° - 77 ° F).
Gefabriceerd voor:
Cephalon, Inc.
Frazer, PA 19355
Amerikaanse octrooischriften. RE37.516 / 4.927.855
© Cephalon, Inc., 2008. Alle rechten voorbehouden
PROV-011
Laatst bijgewerkt: 03/08
Provigil (modafinil) patiëntinformatieblad (In gewoon Engels)
Gedetailleerde informatie over Tekenen, symptomen, oorzaken, behandelingen van slaapstoornissen
De informatie in deze monografie is niet bedoeld om alle mogelijke toepassingen, aanwijzingen, voorzorgsmaatregelen, interacties tussen geneesmiddelen of bijwerkingen te dekken. Deze informatie is algemeen en is niet bedoeld als specifiek medisch advies. Neem contact op met uw arts, apotheker of verpleegkundige als u vragen heeft over de medicijnen die u gebruikt of meer informatie wilt.
terug naar:
~ alle artikelen over slaapstoornissen


