Lantus voor de behandeling van diabetes
Merknaam: Lantus
Generieke naam: insuline glargine
Doseringsvorm: injectie (Lantus mag NIET worden verdund of gemengd met andere insuline of oplossingen)
Inhoud:
Beschrijving
Klinische Farmacologie
Aanwijzingen en gebruik
Contra
waarschuwingen
Voorzorgsmaatregelen
Bijwerkingen
Dosering en administratie
Hoe wordt geleverd
Lantus, insuline glargine (oorsprong van rDNA), patiëntinformatie (In gewoon Engels)
Beschrijving
Lantus® (insuline glargine [rDNA oorsprong] injectie) is een steriele oplossing van insuline glargine voor gebruik als een injectie. Insuline glargine is een recombinant humaan insuline-analoog dat een langwerkend (tot 24 uur werkingsduur), parenteraal bloedglucoseverlagend middel is. (Zien KLINISCHE FARMACOLOGIE). Lantus wordt geproduceerd door recombinant-DNA-technologie met behulp van een niet-pathogene laboratoriumstam van Escherichia coli (K12) als het productieorganisme. Insuline glargine verschilt van humane insuline doordat het aminozuur asparagine op positie A21 wordt vervangen door glycine en twee arginines worden toegevoegd aan de C-terminus van de B-keten. Chemisch gezien is het 21A-Gly-30Ba-L-Arg-30Bb-L-Arg-humane insuline en heeft het de empirische formule C267H404N72O78S6 en een molecuulgewicht van 6063. Het heeft de volgende structuurformule:
Lantus bestaat uit insuline glargine opgelost in een heldere waterige vloeistof. Elke milliliter Lantus (insuline glargine-injectie) bevat 100 IE (3,6378 mg) insuline glargine.
Inactieve ingrediënten voor de injectieflacon van 10 ml zijn 30 mcg zink, 2,7 mg m-cresol, 20 mg glycerol 85%, 20 mcg polysorbaat 20 en water voor injectie.
Inactieve ingrediënten voor de 3 ml patroon zijn 30 mcg zink, 2,7 mg m-cresol, 20 mg glycerol 85% en water voor injectie.
De pH wordt ingesteld door toevoeging van waterige oplossingen van zoutzuur en natriumhydroxide. Lantus heeft een pH van ongeveer 4.
top
Klinische Farmacologie
Werkingsmechanisme
De primaire activiteit van insuline, inclusief insuline glargine, is regulering van het glucosemetabolisme. Insuline en zijn analogen verlagen de bloedsuikerspiegel door de opname van perifere glucose, met name door skeletspieren en vet, te stimuleren en door de productie van hepatische glucose te remmen. Insuline remt lipolyse in de adipocyten, remt proteolyse en verbetert de eiwitsynthese.
farmacodynamiek
Insuline glargine is een humane insuline-analoog die is ontworpen om een lage oplosbaarheid in water te hebben bij een neutrale pH. Bij pH 4 is het, net als in de Lantus-injectieoplossing, volledig oplosbaar. Na injectie in het onderhuidse weefsel wordt de zure oplossing geneutraliseerd, wat leidt tot de vorming van microprecipitaten waaruit kleine hoeveelheden insuline glargine worden langzaam afgegeven, resulterend in een relatief constant concentratie / tijdsprofiel gedurende 24 uur zonder uitgesproken top. Dit profiel maakt een eenmaal daagse dosering mogelijk als basale insuline van een patiënt.
In klinische onderzoeken is het glucoseverlagende effect op molaire basis (d.w.z. bij gelijktijdige toediening) van intraveneuze insuline glargine ongeveer hetzelfde als humane insuline. In euglycemische klemstudies bij gezonde proefpersonen of bij patiënten met diabetes type 1 was het begin van de werking van subcutane insuline glargine langzamer dan humane NPH-insuline. Het effectprofiel van insuline glargine was relatief constant zonder uitgesproken piek en de duur van het effect was verlengd in vergelijking met humane NPH-insuline. Figuur 1 toont de resultaten van een onderzoek bij patiënten met diabetes type 1, uitgevoerd gedurende maximaal 24 uur na de injectie. De mediane tijd tussen injectie en het einde van het farmacologische effect was 14,5 uur (bereik: 9,5 tot 19,3 uur) voor NPH humane insuline en 24 uur (bereik: 10,8 tot> 24,0 uur) (24 uur was het einde van de observatieperiode) voor insuline glargine.
Figuur 1. Activiteitenprofiel bij patiënten met diabetes type 1â €
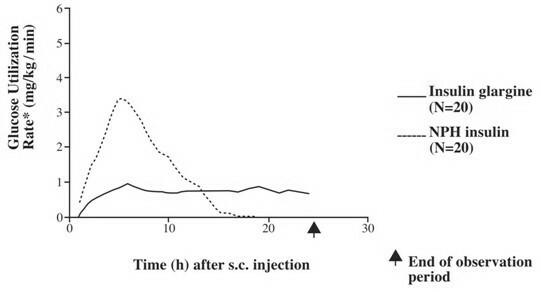
* Bepaald als de hoeveelheid toegediende glucose om de constante glucosewaarden in het plasma te handhaven (gemiddelde waarden per uur); indicatief voor insuline-activiteit.
â € Tussen patiënt-variabiliteit (CV, variatiecoëfficiënt); insuline glargine, 84% en NPH, 78%.
De langere werkingsduur (tot 24 uur) van Lantus is direct gerelateerd aan de lagere absorptiesnelheid en ondersteunt een eenmaal daagse subcutane toediening. Het tijdsverloop van de werking van insulines, inclusief Lantus, kan variëren tussen individuen en / of binnen dezelfde persoon.
farmacokinetiek
Absorptie en biologische beschikbaarheid
Na subcutane injectie van insuline glargine bij gezonde proefpersonen en bij patiënten met diabetes gaven de insulineserumconcentraties een aan langzamere, meer langdurige absorptie en een relatief constant concentratie / tijdsprofiel gedurende 24 uur zonder uitgesproken piek in vergelijking met NPH-mens insuline. Serum insuline concentraties waren dus consistent met het tijdsprofiel van de farmacodynamische activiteit van insuline glargine.
Na subcutane injectie van 0,3 IE / kg insuline glargine bij patiënten met diabetes type 1 is een relatief constant concentratie / tijdsprofiel aangetoond. De werkingsduur na subcutane abdominale, deltoïde of dijbeenbehandeling was vergelijkbaar.
Metabolisme
Een metabolismeonderzoek bij mensen geeft aan dat insuline glargine gedeeltelijk wordt gemetaboliseerd aan het carboxyl-uiteinde van de B-keten in de subcutane depot om twee actieve metabolieten te vormen met in vitro activiteit vergelijkbaar met die van insuline, M1 (21A-Gly-insuline) en M2 (21A-Gly-des-30B-Thr-insuline). Ongewijzigd geneesmiddel en deze afbraakproducten zijn ook aanwezig in de circulatie.
Speciale populaties
Leeftijd, ras en geslacht
Informatie over het effect van leeftijd, ras en geslacht op de farmacokinetiek van Lantus is niet beschikbaar. In gecontroleerde klinische onderzoeken bij volwassenen (n = 3890) en een gecontroleerde klinische studie bij pediatrische patiënten (n = 349), subgroep analyses op basis van leeftijd, ras en geslacht toonden geen verschillen in veiligheid en werkzaamheid tussen insuline glargine en NPH-mens insuline.
Roken
Het effect van roken op de farmacokinetiek / farmacodynamiek van Lantus is niet onderzocht.
Zwangerschap
Het effect van zwangerschap op de farmacokinetiek en farmacodynamiek van Lantus is niet onderzocht (zie VOORZORGSMAATREGELEN, Zwangerschap).
zwaarlijvigheid
In gecontroleerde klinische onderzoeken, waaronder patiënten met een Body Mass Index (BMI) tot en met 49,6 kg / m2, subgroepanalyses op basis van BMI toonden geen verschillen in veiligheid en werkzaamheid tussen insuline glargine en NPH-mens insuline.
Nierinsufficiëntie
Het effect van nierinsufficiëntie op de farmacokinetiek van Lantus is niet onderzocht. Sommige onderzoeken met humane insuline hebben echter verhoogde circulerende insulinespiegels aangetoond bij patiënten met nierfalen. Zorgvuldige glucosemonitoring en dosisaanpassingen van insuline, inclusief Lantus, kunnen nodig zijn bij patiënten met nierdisfunctie (zie VOORZORGSMAATREGELEN, Nierinsufficiëntie).
Leverinsufficiëntie
Het effect van leverinsufficiëntie op de farmacokinetiek van Lantus is niet onderzocht. Sommige onderzoeken met humane insuline hebben echter verhoogde circulerende insulinespiegels aangetoond bij patiënten met leverfalen. Zorgvuldige glucosemonitoring en dosisaanpassingen van insuline, inclusief Lantus, kunnen nodig zijn bij patiënten met leverdisfunctie (zie VOORZORGSMAATREGELEN, Leverinsufficiëntie).
Klinische studies
De veiligheid en effectiviteit van insuline glargine, eenmaal daags voor het slapengaan, werd vergeleken met die van eenmaal daagse en tweemaal daagse NPH menselijke insuline in open-label, gerandomiseerd, actieve controle, parallelle studies van 2327 volwassen patiënten en 349 pediatrische patiënten met diabetes mellitus type 1 en 1563 volwassen patiënten met diabetes mellitus type 2 (zie tabellen 1-3). Over het algemeen was de reductie in geglyceerd hemoglobine (HbA1c) met Lantus vergelijkbaar met die met humane NPH-insuline. De totale percentages hypoglykemie verschilden niet tussen patiënten met diabetes die werden behandeld met Lantus in vergelijking met humane NPH-insuline.
Type 1 diabetes-volwassene (zie tabel 1).
In twee grote, gerandomiseerde, gecontroleerde klinische onderzoeken (onderzoeken A en B), patiënten met diabetes type 1 (onderzoek A; n = 585, studie B; n = 534) werden gerandomiseerd naar basale bolusbehandeling met Lantus eenmaal daags voor het slapengaan of naar NPH humane insuline een- of tweemaal daags en gedurende 28 weken behandeld. Regelmatige humane insuline werd vóór elke maaltijd toegediend. Lantus werd toegediend voor het slapengaan. NPH humane insuline werd eenmaal daags toegediend voor het slapengaan of 's ochtends en voor het slapengaan bij tweemaal daags gebruik. In een groot, gerandomiseerd, gecontroleerd klinisch onderzoek (onderzoek C), patiënten met diabetes type 1 (n = 619) werden gedurende 16 weken behandeld met een basaal-bolusinsuline waarbij vóór elk gebruik insuline lispro werd gebruikt maaltijd. Lantus werd eenmaal daags voor het slapengaan toegediend en menselijke NPH-insuline werd eenmaal of tweemaal daags toegediend. In deze studies hadden Lantus en NPH humane insuline een vergelijkbaar effect op glycohemoglobine met een vergelijkbare algehele hypoglykemie.
Tabel 1: Type 1 Diabetes Mellitus-Adult
| Studie A | Studie B | Studie C | ||||
|---|---|---|---|---|---|---|
| Behandelingsduur | 28 weken | 28 weken | 16 weken | |||
| Behandeling in combinatie met | Regelmatige insuline | Regelmatige insuline | Insuline lispro | |||
| Lantus | NPH | Lantus | NPH | Lantus | NPH | |
| Aantal behandelde personen | 292 | 293 | 264 | 270 | 310 | 309 |
| HbA1c | ||||||
| Eindstudie gemeen | 8.13 | 8.07 | 7.55 | 7.49 | 7.53 | 7.60 |
| Adj. gemiddelde verandering ten opzichte van baseline | +0.21 | +0.10 | -0.16 | -0.21 | -0.07 | -0.08 |
| Lantus - NPH | +0.11 | +0.05 | +0.01 | |||
| 95% BI voor behandelingsverschil | (-0.03; +0.24) | (-0.08; +0.19) | (-0.11; +0.13) | |||
| Basale insulinedosis | ||||||
| Eindstudie gemeen | 19.2 | 22.8 | 24.8 | 31.3 | 23.9 | 29.2 |
| Gemiddelde verandering ten opzichte van baseline | -1.7 | -0.3 | -4.1 | +1.8 | -4.5 | +0.9 |
| Totale insulinedosis | ||||||
| Eindstudie gemeen | 46.7 | 51.7 | 50.3 | 54.8 | 47.4 | 50.7 |
| Gemiddelde verandering ten opzichte van baseline | -1.1 | -0.1 | +0.3 | +3.7 | -2.9 | +0.3 |
| Vastende bloedglucose (mg / dL) | ||||||
| Eindstudie gemeen | 146.3 | 150.8 | 147.8 | 154.4 | 144.4 | 161.3 |
| Adj. gemiddelde verandering ten opzichte van baseline | -21.1 | -16.0 | -20.2 | -16.9 | -29.3 | -11.9 |
Type 1 diabetes-pediatrisch (zie tabel 2).
In een gerandomiseerd, gecontroleerd klinisch onderzoek (onderzoek D), pediatrische patiënten (leeftijdscategorie 6 tot 15 jaar) met type 1 diabetes (n = 349) werden gedurende 28 weken behandeld met een basaal-bolusinsulineregime waarbij vóór elke patiënt normale humane insuline werd gebruikt maaltijd. Lantus werd eenmaal daags voor het slapengaan toegediend en menselijke NPH-insuline werd eenmaal of tweemaal daags toegediend. Vergelijkbare effecten op glycohemoglobine en de incidentie van hypoglykemie werden waargenomen in beide behandelingsgroepen.
Tabel 2: Type 1 Diabetes Mellitus-Pediatric
| Studie D | ||
|---|---|---|
| Behandelingsduur | 28 weken | |
| Behandeling in combinatie met | Regelmatige insuline | |
| Lantus | NPH | |
| Aantal behandelde personen | 174 | 175 |
| HbA1c | ||
| Eindstudie gemeen | 8.91 | 9.18 |
| Adj. gemiddelde verandering ten opzichte van baseline | +0.28 | +0.27 |
| Lantus - NPH | +0.01 | |
| 95% BI voor behandelingsverschil | (-0.24; +0.26) | |
| Basale insulinedosis | ||
| Eindstudie gemeen | 18.2 | 21.1 |
| Gemiddelde verandering ten opzichte van baseline | -1.3 | +2.4 |
| Totale insulinedosis | ||
| Eindstudie gemeen | 45.0 | 46.0 |
| Gemiddelde verandering ten opzichte van baseline | +1.9 | +3.4 |
| Vastende bloedglucose (mg / dL) | ||
| Eindstudie gemeen | 171.9 | 182.7 |
| Adj. gemiddelde verandering ten opzichte van baseline | -23.2 | -12.2 |
Type 2 diabetes-volwassene (zie tabel 3).
In een groot, gerandomiseerd, gecontroleerd klinisch onderzoek (onderzoek E) (n = 570) werd Lantus gedurende 52 weken geëvalueerd als onderdeel van een regime van combinatietherapie met insuline en orale antidiabetesmiddelen (een sulfonylureum, metformine, acarbose of combinaties hiervan verdovende middelen). Lantus eenmaal daags toegediend voor het slapengaan was even effectief als NPH humane insuline eenmaal daags voor het slapengaan toegediend om glycohemoglobine en nuchtere glucose te verminderen. Er was een lage hypoglykemie die vergelijkbaar was bij met Lantus en met NPH behandelde humane insuline-patiënten. In een groot, gerandomiseerd, gecontroleerd klinisch onderzoek (onderzoek F) bij patiënten met diabetes type 2 die geen orale antidiabetica gebruiken (n = 518), een basaal-bolusregime van Lantus eenmaal daags voor het slapengaan of NPH-humane insuline, eenmaal of tweemaal daags toegediend, werd geëvalueerd op 28 weken. Indien nodig werd voor de maaltijd regelmatig humane insuline gebruikt. Lantus had een vergelijkbare effectiviteit als een of twee keer per dag NPH humane insuline bij het verminderen van glycohemoglobine en nuchtere glucose met een vergelijkbare incidentie van hypoglykemie.
Tabel 3: Type 2 diabetes mellitus-volwassene
| Studie E | Studie F | |||
|---|---|---|---|---|
| Behandelingsduur | 52 weken | 28 weken | ||
| Behandeling in combinatie met | Mondelinge agenten | Regelmatige insuline | ||
| Lantus | NPH | Lantus | NPH | |
| Aantal behandelde personen | 289 | 281 | 259 | 259 |
| HbA1c | ||||
| Eindstudie gemeen | 8.51 | 8.47 | 8.14 | 7.96 |
| Adj. gemiddelde verandering ten opzichte van baseline | -0.46 | -0.38 | -0.41 | -0.59 |
| Lantus - NPH | -0.08 | +0.17 | ||
| 95% BI voor behandelingsverschil | (-0.28; +0.12) | (-0.00; +0.35) | ||
| Basale insulinedosis | ||||
| Eindstudie gemeen | 25.9 | 23.6 | 42.9 | 52.5 |
| Gemiddelde verandering ten opzichte van baseline | +11.5 | +9.0 | -1.2 | +7.0 |
| Totale insulinedosis | ||||
| Eindstudie gemeen | 25.9 | 23.6 | 74.3 | 80.0 |
| Gemiddelde verandering ten opzichte van baseline | +11.5 | +9.0 | +10.0 | +13.1 |
| Vastende bloedglucose (mg / dL) | ||||
| Eindstudie gemeen | 126.9 | 129.4 | 141.5 | 144.5 |
| Adj. gemiddelde verandering ten opzichte van baseline | -49.0 | -46.3 | -23.8 | -21.6 |
Lantus Flexibele dagelijkse dosering
De veiligheid en werkzaamheid van Lantus toegediend vóór het ontbijt, vóór het avondeten of voor het slapengaan waren geëvalueerd in een groot, gerandomiseerd, gecontroleerd klinisch onderzoek bij patiënten met diabetes type 1 (onderzoek G, n = 378). Patiënten werden ook tijdens de maaltijd behandeld met insuline lispro. Lantus toegediend op verschillende tijdstippen van de dag resulteerde in vergelijkbare verlagingen van geglyceerd hemoglobine vergeleken met die met toediening voor het slapengaan (zie tabel 4). Bij deze patiënten zijn gegevens beschikbaar van 8-punts thuisglucosemeting. Het maximale gemiddelde bloedglucosegehalte werd waargenomen net vóór injectie van Lantus ongeacht het tijdstip van toediening, d.w.z. vóór het ontbijt, vóór het avondeten of voor het slapen gaan.
In deze studie stopte 5% van de patiënten in de Lantus-ontbijtarm met de behandeling wegens gebrek aan werkzaamheid. Om deze reden stopten geen patiënten in de andere twee armen. Routinemonitoring tijdens deze studie bracht de volgende gemiddelde veranderingen in de systolische bloeddruk aan het licht: pre-ontbijtgroep, 1,9 mm Hg; pre-dinner groep, 0,7 mm Hg; groep voor het slapengaan, -2,0 mm Hg.
De veiligheid en werkzaamheid van Lantus toegediend vóór het ontbijt of voor het slapengaan werden ook geëvalueerd in een grote, gerandomiseerde, actief gecontroleerd klinisch onderzoek (onderzoek H, n = 697) bij diabetes type 2-patiënten niet langer voldoende gecontroleerd op orale middelen behandeling. Alle patiënten in deze studie ontvingen dagelijks 3 mg AMARYL® (glimepiride). Lantus gegeven vóór het ontbijt was minstens even effectief in het verlagen van geglyceerd hemoglobine A1c (HbA1c) als Lantus gegeven voor het slapengaan of NPH humane insuline gegeven voor het slapengaan (zie tabel 4).
Tabel 4: Flexibele Lantus dagelijkse dosering in Type 1 (Studie G) en Type 2 (Studie H) Diabetes Mellitus
| Studie G | Studie H | |||||
|---|---|---|---|---|---|---|
| Treatmentduration | 24 weken | 24 weken | ||||
| Behandeling in combinatie met: | Insuline lispro | AMARYL® (glimepiride) | ||||
| Lantus Ontbijt |
Lantus Avondeten |
Lantus bedtijd |
Lantus Ontbijt |
Lantus bedtijd |
NPH bedtijd |
|
| ||||||
| Aantal behandelde personen* | 112 | 124 | 128 | 234 | 226 | 227 |
| HbA1c | ||||||
| Baseline gemiddelde | 7.56 | 7.53 | 7.61 | 9.13 | 9.07 | 9.09 |
| Eindstudie gemeen | 7.39 | 7.42 | 7.57 | 7.87 | 8.12 | 8.27 |
| Gemiddelde verandering ten opzichte van baseline | -0.17 | -0.11 | -0.04 | -1.26 | -0.95 | -0.83 |
| Basale insulinedosis (IE) | ||||||
| Eindstudie gemeen | 27.3 | 24.6 | 22.8 | 40.4 | 38.5 | 36.8 |
| Gemiddelde verandering ten opzichte van baseline | 5.0 | 1.8 | 1.5 | |||
| Totale insulinedosis (IE) | Naa € | NA | NA | |||
| Eindstudie gemeen | 53.3 | 54.7 | 51.5 | |||
| Gemiddelde verandering ten opzichte van baseline | 1.6 | 3.0 | 2.3 |
top
Aanwijzingen en gebruik
Lantus is geïndiceerd voor eenmaal daagse subcutane toediening voor de behandeling van volwassen en pediatrische patiënten met type 1 diabetes mellitus of volwassen patiënten met diabetes mellitus type 2 die basale (langwerkende) insuline nodig hebben voor de controle van hyperglykemie.
top
Contra
Lantus is gecontra-indiceerd bij patiënten die overgevoelig zijn voor insuline glargine of de hulpstoffen.
top
waarschuwingen
Hypoglykemie is de meest voorkomende bijwerking van insuline, inclusief Lantus. Zoals met alle insulines, kan de timing van hypoglykemie verschillen tussen verschillende insulinesamenstellingen. Glucosebewaking wordt aanbevolen voor alle patiënten met diabetes.
Elke verandering van insuline dient voorzichtig te geschieden en alleen onder medisch toezicht. Veranderingen in insuline sterkte, timing van dosering, fabrikant, type (bijv. Regulier, NPH of insuline-analogen), soort (dier, mens), of productiemethode (recombinant DNA versus insuline van dierlijke oorsprong) kan leiden tot een wijziging in dosering. Gelijktijdige orale behandeling met antidiabetes moet mogelijk worden aangepast.
top
Voorzorgsmaatregelen
Algemeen
Lantus is niet bedoeld voor intraveneuze toediening. De verlengde werkingsduur van insuline glargine is afhankelijk van injectie in subcutaan weefsel. Intraveneuze toediening van de gebruikelijke subcutane dosis kan leiden tot ernstige hypoglykemie.
Lantus mag NIET worden verdund of gemengd met andere insulines of oplossingen. Als Lantus wordt verdund of gemengd, kan de oplossing troebel worden en het farmacokinetische / farmacodynamische profiel (bijv. begin van werking, tijd tot piekeffect) van Lantus en / of de gemengde insuline kan worden veranderd in een onvoorspelbaar manier. Wanneer Lantus en normale humane insuline onmiddellijk vóór injectie bij honden werden gemengd, werd een vertraagde aanvang van de actie en de tijd tot maximaal effect voor reguliere humane insuline waargenomen. De totale biologische beschikbaarheid van het mengsel was ook enigszins verlaagd in vergelijking met afzonderlijke injecties van Lantus en gewone humane insuline. De relevantie van deze waarnemingen bij honden voor mensen is niet bekend.
Zoals met alle insulinepreparaten, kan het tijdsverloop van Lantus-actie variëren bij verschillende personen of bij verschillende tijden in dezelfde persoon en de absorptiesnelheid is afhankelijk van bloedtoevoer, temperatuur en fysiek werkzaamheid.
Insuline kan natriumretentie en oedeem veroorzaken, vooral als eerder slechte metabole controle wordt verbeterd door intensievere insulinetherapie.
hypoglykemie
Zoals bij alle insulinepreparaten, kunnen hypoglykemische reacties gepaard gaan met de toediening van Lantus. Hypoglykemie is de meest voorkomende bijwerking van insulines. Vroege waarschuwingssymptomen van hypoglykemie kunnen onder bepaalde omstandigheden, zoals lang, anders of minder uitgesproken zijn duur van diabetes, diabetes zenuwziekte, gebruik van medicijnen zoals bètablokkers, of versterkte diabetescontrole (zien VOORZORGSMAATREGELEN, Interacties tussen geneesmiddelen). Dergelijke situaties kunnen leiden tot ernstige hypoglykemie (en mogelijk bewustzijnsverlies) voordat patiënten zich bewust worden van hypoglykemie.
Het tijdstip van optreden van hypoglykemie is afhankelijk van het werkingsprofiel van de gebruikte insulines en kan daarom veranderen wanneer het behandelingsregime of tijdstip van dosering wordt gewijzigd. Patiënten die worden overgeschakeld van tweemaal daags NPH-insuline naar eenmaal daags Lantus moeten hun initiaal hebben De dosis Lantus daalde met 20% ten opzichte van de vorige totale dagelijkse NPH-dosis om het risico op hypoglykemie te verminderen (zien DOSERING EN ADMINISTRATIE, Omschakeling naar Lantus).
Het langdurige effect van subcutane Lantus kan het herstel van hypoglykemie vertragen.
In een klinisch onderzoek waren de symptomen van hypoglykemie of tegenregulerende hormoonresponsen vergelijkbaar na intraveneuze insuline glargine en gewone humane insuline, zowel bij gezonde proefpersonen als bij patiënten met type 1 diabetes.
Nierinsufficiëntie
Hoewel er geen studies zijn uitgevoerd bij patiënten met diabetes en nierinsufficiëntie, vereist Lantus kan verminderd zijn vanwege een verminderd insulinemetabolisme, vergelijkbaar met waarnemingen met andere insulines (zien KLINISCHE FARMACOLOGIE, Speciale populaties).
Leverinsufficiëntie
Hoewel er geen studies zijn uitgevoerd bij patiënten met diabetes en leverinsufficiëntie, kan de behoefte aan Lantus verminderd zijn vanwege verminderde capaciteit voor gluconeogenese en verminderd insulinemetabolisme, vergelijkbaar met waarnemingen met andere insulines (zie KLINISCHE FARMACOLOGIE, Speciale populaties).
Injectieplaats en allergische reacties
Zoals bij elke insulinetherapie kan lipodystrofie op de injectieplaats optreden en de insuline-absorptie vertragen. Andere reacties op de injectieplaats met insulinetherapie zijn roodheid, pijn, jeuk, netelroos, zwelling en ontsteking. Continue rotatie van de injectieplaats binnen een bepaald gebied kan deze reacties helpen verminderen of voorkomen. De meeste kleine reacties op insulines verdwijnen meestal binnen enkele dagen tot enkele weken.
Meldingen van pijn op de injectieplaats kwamen vaker voor bij Lantus dan bij humane NPH-insuline (2,7% insuline glargine versus 0,7% NPH). De meldingen van pijn op de injectieplaats waren meestal mild en resulteerden niet in stopzetting van de therapie.
Onmiddellijke allergische reacties zijn zeldzaam. Dergelijke reacties op insuline (inclusief insuline glargine) of de hulpstoffen kunnen bijvoorbeeld in verband worden gebracht met gegeneraliseerde huidreacties, angio-oedeem, bronchospasme, hypotensie of shock en kan leven zijn bedreigend.
Bijkomende voorwaarden
De insulinebehoefte kan worden gewijzigd tijdens bijkomende omstandigheden zoals ziekte, emotionele stoornissen of stress.
Informatie voor patiënten
Lantus mag alleen worden gebruikt als de oplossing helder en kleurloos is zonder zichtbare deeltjes (zie DOSERING EN ADMINISTRATIE, Voorbereiding en gebruik).
Patiënten moeten erop worden gewezen dat Lantus NIET mag worden verdund of gemengd met andere insuline of oplossingen (zie VOORZORGSMAATREGELENAlgemeen).
Patiënten moeten worden geïnstrueerd over zelfmanagementprocedures, waaronder glucosemonitoring, juiste injectietechniek en hypoglykemie en hyperglykemie. Patiënten moeten worden geïnstrueerd in het omgaan met speciale situaties, zoals bijkomende omstandigheden (ziekte, stress of emotioneel) stoornissen), een onvoldoende of overgeslagen insulinedosis, onbedoelde toediening van een verhoogde insulinedosis, onvoldoende voedselinname, of overgeslagen maaltijden. Verwijs patiënten naar de Lantus "Patient Information" -circulaire voor aanvullende informatie.
Zoals bij alle patiënten met diabetes, kan het concentratievermogen en / of reactievermogen verminderd zijn als gevolg van hypoglykemie of hyperglykemie.
Patiënten met diabetes moeten het advies krijgen om hun zorgverlener op de hoogte te stellen als ze zwanger zijn of een zwangerschap overwegen.
Geneesmiddelinteracties
Een aantal stoffen beïnvloedt het glucosemetabolisme en kan aanpassing van de insulinedosis en met name nauwlettend toezicht vereisen.
Hierna volgen voorbeelden van stoffen die het bloedglucoseverlagende effect en de gevoeligheid voor hypoglykemie kunnen vergroten: orale antidiabetesproducten, ACE-remmers, disopyramide, fibraten, fluoxetine, MAO-remmers, propoxyfeen, salicylaten, somatostatine-analoog (bijv. Octreotide), sulfonamide antibiotica.
Hierna volgen voorbeelden van stoffen die het bloedglucoseverlagende effect van insuline kunnen verminderen: corticosteroïden, danazol, diuretica, sympathomimetische middelen (bijv. epinefrine, albuterol, terbutaline), isoniazide, fenothiazinederivaten, somatropine, schildklierhormonen, oestrogenen, progestagenen (bijvoorbeeld in orale anticonceptiva), proteaseremmers en atypische antipsychotische medicijnen (bijvoorbeeld olanzapine en clozapine).
Bètablokkers, clonidine, lithiumzouten en alcohol kunnen het bloedglucoseverlagende effect van insuline versterken of verzwakken. Pentamidine kan hypoglykemie veroorzaken, wat soms kan worden gevolgd door hyperglykemie.
Bovendien kunnen de symptomen van hypoglykemie verminderd of afwezig zijn onder invloed van sympatholytische geneesmiddelen zoals bètablokkers, clonidine, guanethidine en reserpine.
Carcinogenese, mutagenese, aantasting van de vruchtbaarheid
Bij muizen en ratten werden standaard tweejarige carcinogeniteitsstudies met insuline glargine uitgevoerd bij doses tot 0,455 mg / kg, wat voor de rat is ongeveer 10 keer en voor de muis ongeveer 5 keer de aanbevolen humane subcutane startdosis van 10 IE (0,008 mg / kg / dag), gebaseerd op mg / m2. De bevindingen bij vrouwelijke muizen waren niet overtuigend vanwege excessieve mortaliteit in alle dosisgroepen tijdens het onderzoek. Histiocytoma's werden op injectieplaatsen gevonden bij mannelijke ratten (statistisch significant) en mannelijke muizen (niet statistisch significant) in groepen met zuurvehikels. Deze tumoren werden niet gevonden in vrouwelijke dieren, in zoutoplossingcontrole of in insuline-vergelijkingsgroepen die een ander vehikel gebruikten. De relevantie van deze bevindingen voor mensen is onbekend.
Insuline glargine was niet mutageen in tests voor detectie van genmutaties in bacteriën en zoogdiercellen (Ames- en HGPRT-test) en in tests voor detectie van chromosomale afwijkingen (cytogenetica in vitro in V79-cellen en in vivo in het Chinees hamsters).
In een gecombineerd vruchtbaarheids- en prenataal en postnataal onderzoek bij mannelijke en vrouwelijke ratten bij subcutane doses tot 0,36 mg / kg / dag, wat ongeveer 7 keer de aanbevolen humane subcutane startdosis van 10 IE (0,008 mg / kg / dag), op basis van mg / m2, maternale toxiciteit als gevolg van dosisafhankelijke hypoglykemie, inclusief enkele sterfgevallen, was opgemerkt. Bijgevolg trad alleen in de groep met hoge doses een vermindering van de opvoedingssnelheid op. Soortgelijke effecten werden waargenomen met humane NPH-insuline.
Zwangerschap
Teratogene effecten
Zwangerschap Categorie C. Er zijn subcutane reproductie- en teratologiestudies uitgevoerd met insuline glargine en gewone humane insuline bij ratten en Himalaya-konijnen. Het medicijn werd aan vrouwelijke ratten gegeven vóór de paring, tijdens de paring en tijdens de zwangerschap in doses tot 0,36 mg / kg / dag, die ongeveer 7 keer de aanbevolen humane subcutane startdosis van 10 IE (0,008 mg / kg / dag) is, gebaseerd op mg / m2. Bij konijnen doses van 0,072 mg / kg / dag, wat ongeveer 2 keer de aanbevolen mens is subcutane startdosis van 10 IE (0,008 mg / kg / dag), gebaseerd op mg / m2, werd toegediend tijdens organogenese. De effecten van insuline glargine verschilden over het algemeen niet van die waargenomen bij normale humane insuline bij ratten of konijnen. Bij konijnen vertoonden vijf foetussen uit twee nesten van de hooggedoseerde groep echter verwijding van de hersenventrikels. Vruchtbaarheid en vroege embryonale ontwikkeling leken normaal.
Er zijn geen goed gecontroleerde klinische onderzoeken naar het gebruik van insuline glargine bij zwangere vrouwen. Het is essentieel voor patiënten met diabetes of een geschiedenis van zwangerschapsdiabetes om een goede metabole controle te behouden vóór de conceptie en tijdens de zwangerschap. De insulinebehoefte kan tijdens het eerste trimester afnemen, in het algemeen tijdens het tweede en derde trimester toenemen en na aflevering snel afnemen. Zorgvuldige monitoring van glucosecontrole is essentieel bij dergelijke patiënten. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de reactie van de mens, moet dit medicijn alleen tijdens de zwangerschap worden gebruikt als het duidelijk nodig is.
Moeders die borstvoeding geven
Het is onbekend of insuline glargine in significante hoeveelheden wordt uitgescheiden in moedermelk. Veel medicijnen, waaronder humane insuline, worden uitgescheiden in moedermelk. Om deze reden is voorzichtigheid geboden wanneer Lantus wordt toegediend aan een vrouw die borstvoeding geeft. Vrouwen die borstvoeding geven, kunnen aanpassingen van de insulinedosis en het dieet nodig hebben.
Gebruik bij kinderen
De veiligheid en effectiviteit van Lantus zijn vastgesteld in de leeftijdsgroep van 6 tot 15 jaar met diabetes type 1.
Geriatrisch gebruik
In gecontroleerde klinische onderzoeken waarin insuline glargine werd vergeleken met humane NPH-insuline, waren 593 van 3890 patiënten met diabetes type 1 en type 2 65 jaar en ouder. Het enige verschil in veiligheid of effectiviteit in deze subpopulatie in vergelijking met de gehele onderzoekspopulatie was een verwachte hogere incidentie van cardiovasculaire voorvallen in zowel met insuline glargine als met NPH humane insuline behandeld patiënten.
Bij oudere patiënten met diabetes moeten de initiële dosering, dosisverhogingen en onderhoudsdosering conservatief zijn om hypoglycemische reacties te voorkomen. Hypoglykemie kan bij ouderen moeilijk te herkennen zijn (zie VOORZORGSMAATREGELEN, Hypoglykemie).
top
Bijwerkingen
De bijwerkingen die gewoonlijk met Lantus worden geassocieerd, zijn onder meer:
Lichaam als geheel: allergische reacties (zie VOORZORGSMAATREGELEN).
Huid en aanhangsels: reactie op de injectieplaats, lipodystrofie, jeuk, uitslag (zie VOORZORGSMAATREGELEN).
Andere: hypoglykemie (zie WAARSCHUWINGEN en VOORZORGSMAATREGELEN).
In klinische onderzoeken bij volwassen patiënten was er een hogere incidentie van door de behandeling ontstane pijn op de injectieplaats bij met Lantus behandelde patiënten (2,7%) vergeleken met met NPH behandelde insuline (0,7%). De meldingen van pijn op de injectieplaats waren meestal mild en resulteerden niet in stopzetting van de therapie. Andere op de behandeling ontstane reacties op de injectieplaats traden op bij vergelijkbare incidenten met zowel insuline glargine als humane NPH-insuline.
Retinopathie werd geëvalueerd in de klinische studies door middel van gerapporteerde retinale bijwerkingen en fundusfotografie. Het aantal gerapporteerde retinale bijwerkingen voor Lantus- en NPH-behandelingsgroepen was vergelijkbaar voor patiënten met type 1 en type 2 diabetes. Progressie van retinopathie werd onderzocht door fundusfotografie met behulp van een beoordelingsprotocol afgeleid van de Early Treatment Diabetic Retinopathy Study (ETDRS). In een klinische studie met patiënten met diabetes type 2 was er een verschil in het aantal personen met â ‰ ¥ 3-stappen progressie in ETDRS-schaal over een periode van 6 maanden werd opgemerkt door fundusfotografie (7,5% in Lantus-groep versus 2,7% in NPH behandelde groep). De algemene relevantie van deze geïsoleerde bevinding kan niet worden bepaald vanwege het kleine aantal patiënten betrokken, de korte follow-up periode en het feit dat deze bevinding niet werd waargenomen in andere klinische studies.
top
Overdose
Een teveel aan insuline ten opzichte van voedselinname, energieverbruik of beide kunnen leiden tot ernstige en soms langdurige en levensbedreigende hypoglykemie. Milde episoden van hypoglykemie kunnen meestal worden behandeld met orale koolhydraten. Aanpassingen in de dosering van het geneesmiddel, maaltijdpatronen of lichaamsbeweging kunnen nodig zijn.
Meer ernstige episodes met coma, epileptische aanvallen of neurologische stoornissen kunnen worden behandeld met intramusculaire / subcutane glucagon of geconcentreerde intraveneuze glucose. Na duidelijk klinisch herstel van hypoglykemie, kan voortdurende observatie en extra inname van koolhydraten nodig zijn om herhaling van hypoglykemie te voorkomen.
top
Dosering en administratie
Lantus is een recombinant humaan insuline-analoog. De potentie is ongeveer hetzelfde als humane insuline. Het vertoont een relatief constant glucoseverlagend profiel gedurende 24 uur dat een eenmaal daagse dosering mogelijk maakt.
Lantus kan op elk moment van de dag worden toegediend. Lantus moet eenmaal daags elke dag op hetzelfde tijdstip worden toegediend. Voor patiënten die de timing van de dosering met Lantus aanpassen, zie WAARSCHUWINGEN en VOORZORGSMAATREGELENHypoglykemie. Lantus is niet bedoeld voor intraveneuze toediening (zie VOORZORGSMAATREGELEN). Intraveneuze toediening van de gebruikelijke subcutane dosis kan leiden tot ernstige hypoglykemie. De gewenste bloedglucosewaarden evenals de doses en timing van antidiabetesmedicatie moeten individueel worden bepaald. Bloedglucosebewaking wordt aanbevolen voor alle patiënten met diabetes. De verlengde werkingsduur van Lantus is afhankelijk van injectie in de onderhuidse ruimte.
Zoals bij alle insulines, moeten injectieplaatsen in een injectiezone (buik, dij of deltoïde) van de ene injectie naar de andere worden gedraaid.
In klinische onderzoeken was er geen relevant verschil in de absorptie van insuline glargine na subcutane abdominale, deltoïde of dijbeenbehandeling. Zoals voor alle insulines, kan de absorptiesnelheid en bijgevolg het begin en de werkingsduur worden beïnvloed door inspanning en andere variabelen.
Lantus is niet de insuline bij uitstek voor de behandeling van diabetes ketoacidose. Intraveneuze kortwerkende insuline is de voorkeursbehandeling.
Gebruik bij kinderen
Lantus kan veilig worden toegediend aan pediatrische patiënten van 6 ¥ 6 jaar. Toediening aan pediatrische patiënten
Initiatie van Lantus-therapie
In een klinische studie met insuline-naïeve patiënten met type 2 diabetes die al met orale antidiabetesmiddelen werden behandeld, werd Lantus gestart een gemiddelde dosis van 10 IE eenmaal daags, en vervolgens aangepast aan de behoefte van de patiënt tot een totale dagelijkse dosis van 2 tot 100 IU.
Omschakeling naar Lantus
Als u overschakelt van een behandelingsregime met een middellang- of langwerkende insuline naar een regime met Lantus, de hoeveelheid en timing van kortwerkende insuline of snelwerkende insuline-analoog of de dosis van een oraal antidiabetes medicijn moet mogelijk zijn bijgestelde. In klinische onderzoeken, toen patiënten werden overgezet van humane NPH-insuline eenmaal daags of ultralente humane insuline naar Lantus eenmaal daags, werd de aanvangsdosis meestal niet gewijzigd. Toen patiënten echter eenmaal daags werden overgebracht van tweemaal daagse NPH-insuline naar Lantus om het risico op hypoglykemie te verminderen, dosis (IE) werd gewoonlijk verlaagd met ongeveer 20% (vergeleken met de totale dagelijkse IE NPH humane insuline) en vervolgens aangepast op basis van de respons van de patiënt (zien VOORZORGSMAATREGELEN, Hypoglykemie).
Een programma van nauwgezette metabole monitoring onder medisch toezicht wordt aanbevolen tijdens de overdracht en in de eerste weken daarna. De hoeveelheid en timing van kortwerkende insuline of snelwerkende insuline-analoog moet mogelijk worden aangepast. Dit geldt met name voor patiënten met verworven antilichamen tegen humane insuline die hoge insulinedoses nodig hebben en komt voor bij alle insuline-analogen. Dosisaanpassing van Lantus en andere insulines of orale geneesmiddelen tegen diabetes kan nodig zijn; bijvoorbeeld als de timing van de dosering, het gewicht of de levensstijl verandert, of andere omstandigheden ontstaan die de gevoeligheid voor hypoglykemie of hyperglykemie vergroten (zie VOORZORGSMAATREGELEN, Hypoglykemie).
De dosis moet mogelijk ook worden aangepast tijdens een bijkomende ziekte (zie VOORZORGSMAATREGELEN, Bijkomende voorwaarden).
Voorbereiding en behandeling
Parenterale geneesmiddelen moeten vóór toediening visueel worden geïnspecteerd wanneer de oplossing en de verpakking dit toelaten. Lantus mag alleen worden gebruikt als de oplossing helder en kleurloos is en er geen deeltjes zichtbaar zijn.
Mengen en verdunnen: Lantus mag NIET worden verdund of gemengd met andere insuline of oplossingen (zie VOORZORGSMAATREGELENAlgemeen).
Injectieflacon: de spuiten mogen geen ander geneesmiddel of residu bevatten.
Cartridgesysteem: Als OptiClik®, het insulinetoedieningsapparaat voor Lantus, defect is, kan Lantus uit het cartridgesysteem in een U-100-spuit worden getrokken en geïnjecteerd.
top
Hoe wordt geleverd
Lantus 100 eenheden per ml (U-100) is beschikbaar in de volgende verpakkingsgrootte:
10 ml injectieflacons (NDC 0088-2220-33)
3 ml cartridgesysteem1, pakket van 5 (NDC 0088-2220-52)
1Cartridgesystemen zijn alleen voor gebruik in OptiClik® (insulinetoedieningsapparaat)
opslagruimte
Ongeopend flacon / patroon-systeem
Ongeopende Lantus-injectieflacons en patroonsystemen moeten worden bewaard in de koelkast, 2 ° C - 8 ° C (36 ° F - 46 ° F). Lantus mag niet in de vriezer worden bewaard en mag niet worden ingevroren.
Gooi weg als het bevroren is.
Open (in gebruik) flacon / patroon-systeem
Geopende injectieflacons, al dan niet gekoeld, moeten binnen 28 dagen na het eerste gebruik worden gebruikt. Ze moeten worden weggegooid als ze niet binnen 28 dagen worden gebruikt. Als koeling niet mogelijk is, kan de open flacon tot 28 dagen ongekoeld worden bewaard, uit de buurt van directe hitte en licht, zolang de temperatuur niet hoger is dan 86 ° F (30 ° C).
Het geopende (in gebruik) cartridgesysteem in OptiClik® mag NIET in de koelkast worden bewaard, maar moet bij kamertemperatuur (onder 30 ° C) uit de buurt van directe hitte en licht worden bewaard. Het geopende (in gebruik) cartridgesysteem in OptiClik®, bewaard bij kamertemperatuur, moet na 28 dagen worden weggegooid. Bewaar OptiClik® nooit met of zonder cartridgesysteem in de koelkast.
Lantus mag niet in de vriezer worden bewaard en mag niet worden ingevroren. Gooi weg als het bevroren is.
Deze opslagomstandigheden zijn samengevat in de volgende tabel:
| Niet in gebruik (Ongeopend) gekoelde |
Niet in gebruik (Ongeopend) Kamertemperatuur |
In gebruik (Geopend) (Zie temperatuur hieronder) |
|
|---|---|---|---|
| Injectieflacon van 10 ml | Tot de vervaldatum | 28 dagen | 28 dagen Gekoeld of op kamertemperatuur |
| 3 ml cartridgesysteem | Tot de vervaldatum | 28 dagen | 28 dagen Gekoeld of op kamertemperatuur |
| 3 ml patroon systeem ingevoegd in OptiClik® |
28 dagen Alleen kamertemperatuur (Niet in de koelkast) |
Gefabriceerd voor een distributie door:
sanofi-aventis U.S. LLC
Bridgewater NJ 08807
Gemaakt in Duitsland
www. Lantus.com
© 2006 sanofi-aventis U.S. LLC
OptiClik® is een geregistreerd handelsmerk van sanofi-aventis U.S. LLC, Bridgewater NJ 08807
laatst bijgewerkt 04/2006
Lantus, insuline glargine (oorsprong van rDNA), patiëntinformatie (In gewoon Engels)
Gedetailleerde informatie over tekenen, symptomen, oorzaken, behandelingen van diabetes
De informatie in deze monografie is niet bedoeld om alle mogelijke toepassingen, aanwijzingen, voorzorgsmaatregelen, interacties tussen geneesmiddelen of bijwerkingen te dekken. Deze informatie is algemeen en is niet bedoeld als specifiek medisch advies. Neem contact op met uw arts, apotheker of verpleegkundige als u vragen heeft over de medicijnen die u gebruikt of meer informatie wenst.
terug naar: Blader door alle medicijnen voor diabetes


