Onglyza voor de behandeling van diabetes
Merknaam: Onglyza
Generieke naam: Saxagliptin
Doseringsvorm: tablet, filmomhuld
Inhoud:
Aanwijzingen en gebruik
Dosering en administratie
Doseringsvormen en sterktes
Contra
Waarschuwingen en voorzorgsmaatregelen
Bijwerkingen
Geneesmiddelinteracties
Gebruik in specifieke populaties
overdosering
Beschrijving
farmacologie
Niet-klinische Toxicologie
Klinische studies
Hoe geleverd
Onglyza patiëntinformatie (In gewoon Engels)
Aanwijzingen en gebruik
Monotherapie en combinatietherapie
Onglyza is geïndiceerd als een aanvulling op dieet en lichaamsbeweging om de glykemische controle bij volwassenen met diabetes mellitus type 2 te verbeteren. [Zien Klinische studies].
Belangrijke gebruiksbeperkingen
Onglyza mag niet worden gebruikt voor de behandeling van type 1 diabetes mellitus of diabetische ketoacidose, omdat het in deze omstandigheden niet effectief zou zijn.
Onglyza is niet onderzocht in combinatie met insuline.
top
Dosering en administratie
Aanbevolen dosering
De aanbevolen dosis Onglyza is 2,5 mg of 5 mg eenmaal daags, ongeacht de maaltijden.
Patiënten met nierinsufficiëntie
Er wordt geen dosisaanpassing voor Onglyza aanbevolen voor patiënten met een lichte nierfunctiestoornis (creatinineklaring [CrCl]> 50 ml / min).
De dosis Onglyza is eenmaal daags 2,5 mg voor patiënten met matige of ernstige nierinsufficiëntie, of met eindstadium nierziekte (ESRD) die hemodialyse vereist (creatinineklaring [CrCl] â ‰ ¤50 ml / min). Onglyza moet worden toegediend na hemodialyse. Onglyza is niet onderzocht bij patiënten die peritoneale dialyse ondergaan.
Omdat de dosis Onglyza moet worden beperkt tot 2,5 mg op basis van de nierfunctie, wordt beoordeling van de nierfunctie aanbevolen voorafgaand aan de start van Onglyza en periodiek daarna. De nierfunctie kan worden geschat op basis van serumcreatinine met behulp van de Cockcroft-Gault-formule of Modification of Diet in de formule voor nierziekte. [Zien Klinische Farmacologie, Pharmacokinetics.]
Sterke CYP3A4 / 5-remmers
De dosis Onglyza is eenmaal daags 2,5 mg bij gelijktijdige toediening met sterke cytochroom P450 3A4 / 5 (CYP3A4 / 5) -remmers (bijv. ketoconazol, atazanavir, clarithromycine, indinavir, itraconazol, nefazodon, nelfinavir, ritonavir, saquinavir en telithromycine). [Zien Geneesmiddelinteracties, Remmers van CYP3A4 / 5-enzymen en Klinische Farmacologie, Pharmacokinetics.]
top
Doseringsvormen en sterktes
- Onglyza (saxagliptine) 5 mg tabletten zijn roze, biconvexe, ronde, filmomhulde tabletten met "5" aan één zijde bedrukt en "4215" aan de andere zijde, in blauwe inkt.
- Onglyza (saxagliptine) 2,5 mg tabletten zijn lichtgele tot lichtgele, biconvexe, ronde, filmomhulde tabletten met "2.5" aan één zijde bedrukt en "4214" aan de andere zijde bedrukt, in blauwe inkt.
top
Contra
Geen.
top
Waarschuwingen en voorzorgsmaatregelen
Gebruik met medicijnen waarvan bekend is dat ze hypoglykemie kunnen veroorzaken
Insulinesecretagogen, zoals sulfonylureumderivaten, veroorzaken hypoglykemie. Daarom kan een lagere dosis van de insulinesecretagoog nodig zijn om het risico op hypoglykemie te verminderen bij gebruik in combinatie met Onglyza. [Zien Bijwerkingen, Klinische proeven ervaring.]
Macrovasculaire resultaten
Er zijn geen klinische onderzoeken geweest die overtuigend bewijs van macrovasculaire risicoreductie met Onglyza of andere antidiabetica hebben aangetoond.
top
Bijwerkingen
Klinische proeven Ervaring
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, zijn bijwerkingen waargenomen in de klinische onderzoeken van een geneesmiddel kan niet direct worden vergeleken met de tarieven in de klinische proeven met een ander geneesmiddel en is mogelijk geen afspiegeling van de waargenomen waarden in praktijk.
Monotherapie en aanvullende combinatietherapie
In twee placebogecontroleerde monotherapie-onderzoeken met een duur van 24 weken werden patiënten behandeld met Onglyza 2,5 mg per dag, Onglyza 5 mg per dag en placebo. Drie 24 weken durende, placebogecontroleerde, add-on combinatietherapietesten werden ook uitgevoerd: één met metformine, één met een thiazolidinedione (pioglitazon of rosiglitazon) en één met glyburide. In deze drie onderzoeken werden patiënten gerandomiseerd om therapie toe te voegen met Onglyza 2,5 mg per dag, Onglyza 5 mg per dag of placebo. Een saxagliptine-behandelingsarm van 10 mg werd opgenomen in een van de monotherapie-onderzoeken en in het add-on combinatieonderzoek met metformine.
In een vooraf gespecificeerde gepoolde analyse van de 24-weken gegevens (ongeacht de glycemische redding) van de twee monotherapie-onderzoeken, de add-on voor metformine-studie, de add-on voor thiazolidinedione (TZD) -studie, en de add-on voor glyburideproef, de totale incidentie van bijwerkingen bij patiënten behandeld met Onglyza 2,5 mg en Onglyza 5 mg was vergelijkbaar met placebo (72,0% en 72,2% versus 70,6%, respectievelijk). Stopzetting van de behandeling vanwege bijwerkingen trad op bij respectievelijk 2,2%, 3,3% en 1,8% van de patiënten die respectievelijk Onglyza 2,5 mg, Onglyza 5 mg en placebo kregen. De meest voorkomende bijwerkingen (gemeld bij minstens 2 patiënten behandeld met Onglyza 2,5 mg of minstens 2 patiënten behandeld met Onglyza 5 mg) geassocieerd met voortijdige stopzetting van de behandeling omvatte lymfopenie (respectievelijk 0,1% en 0,5% versus 0%), uitslag (0,2% en 0,3% versus 0,3%), bloedcreatinine nam toe (0,3% en 0% versus 0%) en bloedcreatinefosfokinase nam toe (0,1% en 0,2% versus 0%). De bijwerkingen in deze gepoolde analyse zijn gemeld (ongeacht de oorzakelijkheid van de onderzoeker) â ‰ ¥ 5% van de patiënten behandeld met Onglyza 5 mg, en vaker dan bij patiënten behandeld met placebo worden getoond in Tafel 1.
Tabel 1: Bijwerkingen (ongeacht de onderzoeker van de causaliteit) in placebogecontroleerde onderzoeken * Gemeld bij â ‰ ¥ 5% van de patiënten behandeld met Onglyza 5 mg en vaker dan bij patiënten behandeld met Placebo
| Aantal (%) patiënten | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
Placebo N = 799 |
|
| * De 5 placebogecontroleerde onderzoeken omvatten twee onderzoeken naar monotherapie en een aanvullende combinatietherapie met elk van de volgende onderzoeken: metformine, thiazolidinedione of glyburide. Tabel toont gegevens over 24 weken ongeacht glycemische redding. | ||
| Bovenste luchtweginfectie | 68 (7.7) | 61 (7.6) |
| Urineweginfectie | 60 (6.8) | 49 (6.1) |
| Hoofdpijn | 57 (6.5) | 47 (5.9) |
Bij patiënten die met Onglyza 2,5 mg werden behandeld, was hoofdpijn (6,5%) de enige bijwerking die met een snelheid â?? ¥ 5% en vaker werd gemeld dan bij patiënten die met placebo werden behandeld.
In deze gepoolde analyse omvatten bijwerkingen die werden gemeld bij â ‰ ¥ 2% van de patiënten die werden behandeld met Onglyza 2,5 mg of Onglyza 5 mg en â ‰ ¥ 1% vaker vergeleken met placebo: sinusitis (respectievelijk 2,9% en 2,6% versus 1,6%), buikpijn (2,4% en 1,7% versus 0,5%), gastro-enteritis (1,9% en 2,3% versus 0,9%) en braken (2,2% en 2,3% versus 1,3%) ).
In de add-on bij de TZD-studie was de incidentie van perifeer oedeem hoger voor Onglyza 5 mg versus placebo (respectievelijk 8,1% en 4,3%). De incidentie van perifeer oedeem voor Onglyza 2,5 mg was 3,1%. Geen van de gemelde bijwerkingen van perifeer oedeem resulteerde in stopzetting van het onderzoeksgeneesmiddel. Perifere oedeempercentages voor Onglyza 2,5 mg en Onglyza 5 mg versus placebo waren 3,6% en 2% versus 3% gegeven als monotherapie, 2,1% en 2,1% versus 2,2% gegeven als aanvullende therapie voor metformine, en 2,4% en 1,2% versus 2,2% gegeven als aanvullende therapie voor Glyburide.
De incidentie van fracturen was respectievelijk 1,0 en 0,6 per 100 patiëntjaren voor Onglyza (gepoolde analyse van 2,5 mg, 5 mg en 10 mg) en placebo. De incidentie van fracturen bij patiënten die Onglyza kregen, nam in de loop van de tijd niet toe. Causaliteit is niet vastgesteld en niet-klinische onderzoeken hebben geen nadelige effecten van saxagliptine op het bot aangetoond.
Een gebeurtenis van trombocytopenie, consistent met een diagnose van idiopathische trombocytopenische purpura, werd waargenomen in het klinische programma. De relatie van dit evenement met Onglyza is niet bekend.
Bijwerkingen geassocieerd met Onglyza Gelijktijdig toegediend met metformine bij behandelingsnaïeve patiënten met diabetes type 2
Tabel 2 toont de gemelde bijwerkingen (ongeacht de oorzakelijk verband door de onderzoeker) bij â ‰ ¥ 5% van de patiënten deelnemen aan een aanvullend, 24-weeks, actief gecontroleerd onderzoek van gelijktijdig toegediende Onglyza en metformine bij niet eerder behandeld patiënten.
Tabel 2: Initiële therapie met combinatie van Onglyza en metformine bij patiënten die niet eerder behandeld zijn: bijwerkingen gemeld (ongeacht onderzoek door onderzoeker) van causaliteit) bij â € ¥ 5% van de patiënten behandeld met combinatietherapie van Onglyza 5 mg plus metformine (en vaker dan bij patiënten behandeld met metformine Alleen)
| Aantal (%) patiënten | ||
|---|---|---|
| Onglyza 5 mg + Metformin * N = 320 |
metformine * N = 328 |
|
| * Metformine werd gestart met een startdosis van 500 mg per dag en getitreerd tot een maximum van 2000 mg per dag. | ||
| Hoofdpijn | 24 (7.5) | 17 (5.2) |
| nasofaryngitis | 22 (6.9) | 13 (4.0) |
hypoglykemie
Bijwerkingen van hypoglykemie waren gebaseerd op alle meldingen van hypoglykemie; een gelijktijdige glucosemeting was niet vereist. In de add-on voor glyburidestudie was de totale incidentie van gerapporteerde hypoglykemie hoger voor Onglyza 2,5 mg en Onglyza 5 mg (13,3% en 14,6%) versus placebo (10,1%). De incidentie van bevestigde hypoglykemie in deze studie, gedefinieerd als symptomen van hypoglykemie gepaard met een vingerprikglucosewaarde van â ‰ ¤50 mg / dL, was 2,4% en 0,8% voor Onglyza 2,5 mg en Onglyza 5 mg en 0,7% voor placebo. De incidentie van gerapporteerde hypoglykemie voor Onglyza 2,5 mg en Onglyza 5 mg versus placebo gegeven als monotherapie was 4,0% en 5,6% versus 4,1%, respectievelijk 7,8% en 5,8% versus 5% gegeven als aanvullende therapie voor metformine, en 4,1% en 2,7% versus 3,8% gegeven als aanvullende therapie voor TZD. De incidentie van gerapporteerde hypoglykemie was 3,4% bij niet eerder behandelde patiënten die Onglyza 5 mg plus metformine kregen en 4,0% bij patiënten die alleen metformine kregen.
Overgevoeligheidsreacties
Overgevoeligheidsgerelateerde gebeurtenissen, zoals urticaria en gezichtsoedeem in de gepoolde 5-studie analyse tot week 24 werden gemeld bij 1,5%, 1,5% en 0,4% van de patiënten die 2,5 mg Onglyza, 5 mg Onglyza en placebo kregen, respectievelijk. Geen van deze gebeurtenissen bij patiënten die Onglyza kregen, vereiste ziekenhuisopname of werd door de onderzoekers als levensbedreigend gemeld. Eén met saxagliptine behandelde patiënt in deze gepoolde analyse stopte vanwege gegeneraliseerde urticaria en gezichtsoedeem.
Vitale tekenen
Er zijn geen klinisch significante veranderingen in vitale functies waargenomen bij patiënten die werden behandeld met Onglyza.
Laboratorium testen
Absolute lymfocyten telt
Er was een dosisgerelateerde gemiddelde afname van het absolute aantal lymfocyten waargenomen met Onglyza. Uit een basislijngemiddeld absoluut aantal lymfocyten van ongeveer 2200 cellen / microL, gemiddelde dalingen van ongeveer 100 en 120 cellen / microL met Onglyza 5 mg en 10 mg, respectievelijk, ten opzichte van placebo werden na 24 weken waargenomen in een gepoolde analyse van vijf placebo-gecontroleerde klinische studies. Vergelijkbare effecten werden waargenomen wanneer Onglyza 5 mg in eerste combinatie met metformine werd gegeven in vergelijking met alleen metformine. Er werd geen verschil waargenomen voor Onglyza 2,5 mg ten opzichte van placebo. Het aandeel patiënten waarvan gemeld werd dat ze een aantal lymfocyten hadden - ¤ ¤ 750 cellen / microL was respectievelijk 0,5%, 1,5%, 1,4% en 0,4% in de saxagliptine 2,5 mg, 5 mg, 10 mg en placebogroepen. Bij de meeste patiënten werd recidief niet waargenomen bij herhaalde blootstelling aan Onglyza, hoewel sommige patiënten terugkerende dalingen hadden bij rechallenge die leidde tot stopzetting van Onglyza. De afname van het aantal lymfocyten was niet geassocieerd met klinisch relevante bijwerkingen.
De klinische significantie van deze afname van het aantal lymfocyten ten opzichte van placebo is niet bekend. Wanneer klinisch geïndiceerd, zoals in een setting van ongebruikelijke of langdurige infectie, moet het aantal lymfocyten worden gemeten. Het effect van Onglyza op het aantal lymfocyten bij patiënten met lymfocytenafwijkingen (bijvoorbeeld humaan immunodeficiëntievirus) is onbekend.
bloedplaatjes
Onglyza vertoonde geen klinisch betekenisvol of consistent effect op het aantal bloedplaatjes in de zes, dubbelblinde, gecontroleerde klinische onderzoeken naar veiligheid en werkzaamheid.
top
Geneesmiddelinteracties
Inductoren van CYP3A4 / 5-enzymen
Rifampin verminderde de blootstelling aan saxagliptine aanzienlijk zonder verandering van het gebied onder de tijdconcentratiecurve (AUC) van zijn actieve metaboliet, 5-hydroxysaxagliptine. De remming van de activiteit van plasma-dipeptidylpeptidase-4 (DPP4) gedurende een dosisinterval van 24 uur werd niet beïnvloed door rifampin. Daarom wordt dosisaanpassing van Onglyza niet aanbevolen. [Zien Klinische Farmacologie, Pharmacokinetics.]
Remmers van CYP3A4 / 5-enzymen
Matige remmers van CYP3A4 / 5
Diltiazem verhoogde de blootstelling aan saxagliptine. Soortgelijke verhogingen van plasmaconcentraties van saxagliptine worden verwacht in aanwezigheid van andere matige CYP3A4 / 5 remmers (bijv. amprenavir, aprepitant, erytromycine, fluconazol, fosamprenavir, grapefruitsap en verapamil); aanpassing van de dosering van Onglyza wordt echter niet aanbevolen. [Zien Klinische Farmacologie, Pharmacokinetics.]
Sterke remmers van CYP3A4 / 5
Ketoconazol verhoogde de blootstelling aan saxagliptine aanzienlijk. Soortgelijke significante verhogingen van plasmaconcentraties van saxagliptine worden verwacht met andere sterke CYP3A4 / 5-remmers (bijvoorbeeld atazanavir, claritromycine, indinavir, itraconazol, nefazodon, nelfinavir, ritonavir, saquinavir en telithromycine). De dosis Onglyza moet worden beperkt tot 2,5 mg bij gelijktijdige toediening met een sterke CYP3A4 / 5-remmer. [Zien Dosering en administratie, Sterke CYP3A4 / 5-remmers en Klinische Farmacologie, Pharmacokinetics.]
top
Gebruik in specifieke populaties
Zwangerschap
Zwangerschap Categorie B
Er zijn geen adequate en goed gecontroleerde studies bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de reactie van de mens, moet Onglyza, net als andere antidiabetische medicijnen, alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Saxagliptine was niet teratogeen bij elke geteste dosis bij toediening aan zwangere ratten en konijnen tijdens perioden van organogenese. Onvolledige ossificatie van het bekken, een vorm van ontwikkelingsachterstand, trad op bij ratten bij een dosis van 240 mg / kg of ongeveer 1503 en 66 keer de blootstelling van de mens aan respectievelijk saxagliptine en de actieve metaboliet bij de maximale aanbevolen dosis voor mensen (MRHD) van 5 mg. Maternale toxiciteit en verlaagd foetaal lichaamsgewicht werden waargenomen bij respectievelijk 7986 en 328 maal de menselijke blootstelling aan de MRHD voor saxagliptine en de actieve metaboliet. Kleine skeletvariaties bij konijnen traden op bij een maternaal toxische dosis van 200 mg / kg, of ongeveer 1432 en 992 maal de MRHD. Bij toediening aan ratten in combinatie met metformine was saxagliptine niet teratogeen of embryolethaal bij blootstellingen van 21 keer de saxagliptine MRHD. Combinatietoediening van metformine met een hogere dosis saxagliptine (109 maal de saxagliptine MRHD) werd geassocieerd met craniorachischisis (een zeldzaam neuraal buisdefect gekenmerkt door onvolledige sluiting van de schedel en de wervelkolom) in twee foetussen van een enkele dam. Metformine-blootstellingen in elke combinatie waren 4 keer de menselijke blootstelling van 2000 mg per dag.
Saxagliptine toegediend aan vrouwelijke ratten vanaf dracht 6 tot lactatiedag 20 resulteerde in verlaagd lichaamsgewicht bij mannen en vrouwelijke nakomelingen alleen bij maternaal toxische doses (blootstellingen â ‰ ¥ 1629 en 53 keer saxagliptine en zijn actieve metaboliet bij de MRHD). Er werd geen functionele of gedragstoxiciteit waargenomen bij nakomelingen van ratten die bij elke dosis saxagliptine kregen toegediend.
Saxagliptine passeert de placenta in de foetus na dosering bij zwangere ratten.
Moeders die borstvoeding geven
Saxagliptine wordt uitgescheiden in de melk van lacterende ratten in een verhouding van ongeveer 1: 1 met plasmaconcentraties van het geneesmiddel. Het is niet bekend of saxagliptine wordt uitgescheiden in moedermelk. Omdat veel medicijnen worden uitgescheiden in moedermelk, is voorzichtigheid geboden wanneer Onglyza wordt toegediend aan een vrouw die borstvoeding geeft.
Gebruik bij kinderen
De veiligheid en effectiviteit van Onglyza bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
In de zes dubbelblinde, gecontroleerde klinische onderzoeken naar veiligheid en werkzaamheid van Onglyza waren 634 (15,3%) van de 4148 gerandomiseerde patiënten 65 jaar en ouder, en 59 (1,4%) patiënten waren 75 jaar en ouder. Er werden geen algemene verschillen in veiligheid of effectiviteit waargenomen tussen patiënten van 65 jaar en jongere patiënten. Hoewel deze klinische ervaring geen verschillen in respons tussen oudere en jongere patiënten heeft vastgesteld, kan een grotere gevoeligheid van sommige oudere personen niet worden uitgesloten.
Saxagliptine en zijn actieve metaboliet worden gedeeltelijk geëlimineerd door de nier. Omdat oudere patiënten vaker een verminderde nierfunctie hebben, is voorzichtigheid geboden bij de dosiskeuze bij ouderen op basis van de nierfunctie. [Zien Dosering en administratie, Patiënten met nierinsufficiëntie en Klinische Farmacologie, Pharmacokinetics.]
top
overdosering
In een gecontroleerde klinische studie, eenmaal daags oraal toegediend Onglyza bij gezonde proefpersonen in doses tot 400 mg per dag gedurende 2 weken (80 keer de MRHD) had geen dosisgerelateerde klinische bijwerkingen en geen klinisch betekenisvol effect op QTc-interval of hart rate.
In het geval van een overdosis moet een geschikte ondersteunende behandeling worden ingesteld zoals voorgeschreven door de klinische status van de patiënt. Saxagliptine en zijn actieve metaboliet worden verwijderd door hemodialyse (23% van de dosis gedurende 4 uur).
top
Beschrijving
Saxagliptine is een oraal actieve remmer van het DPP4-enzym.
Saxagliptinemonohydraat wordt chemisch beschreven als (1S, 3S, 5S) -2 - [(2S) -2-Amino-2- (3-hydroxytricyclo [3.3.1.13,7] dec-1-yl) acetyl] -2-azabicyclo [3.1.0] hexaan-3-carbonitril, monohydraat of (1S, 3S, 5S) - 2 - [(2S) - 2 - Amino - 2 - (3 - hydroxyadamantan - 1 - yl) acetyl] - 2 - azabicyclo [3.1.0] hexaan - 3 - carbonitril hydraat. De empirische formule is C18H25N3O2-H2O en het molecuulgewicht is 333,43. De structuurformule is:
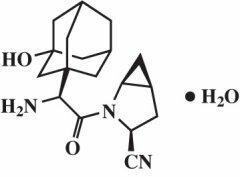
Saxagliptin monohydraat is een wit tot lichtgeel of lichtbruin, niet-hygroscopisch, kristallijn poeder. Het is matig oplosbaar in water bij 24 ° C ± 3 ° C, enigszins oplosbaar in ethylacetaat en oplosbaar in methanol, ethanol, isopropylalcohol, acetonitril, aceton en polyethyleenglycol 400 (PEG 400).
Elke filmomhulde tablet Onglyza voor oraal gebruik bevat 2,79 mg saxagliptinehydrochloride (watervrij) overeenkomend met 2,5 mg saxagliptine of 5,58 mg saxagliptine hydrochloride (watervrij) overeenkomend met 5 mg saxagliptine en de volgende inactieve ingrediënten: lactosemonohydraat, microkristallijne cellulose, natriumcroscarmellose en magnesium stearaat. Bovendien bevat de filmcoating de volgende inactieve ingrediënten: polyvinylalcohol, polyethyleenglycol, titaniumdioxide, talk en ijzeroxiden.
top
Klinische Farmacologie
Werkingsmechanisme
Verhoogde concentraties van de incretine-hormonen zoals glucagonachtig peptide-1 (GLP-1) en glucose-afhankelijk insuline-tropisch polypeptide (GIP) wordt in reactie op maaltijden. Deze hormonen veroorzaken insuline-afgifte uit de pancreatische bètacellen op een glucoseafhankelijke manier, maar worden binnen enkele minuten geïnactiveerd door het dipeptidylpeptidase-4 (DPP4) -enzym. GLP-1 verlaagt ook glucagonafscheiding uit alvleesklier-alfacellen, waardoor de glucoseproductie in de lever wordt verminderd. Bij patiënten met diabetes type 2 zijn de GLP-1-concentraties verlaagd, maar de insulinerespons op GLP-1 is behouden. Saxagliptine is een competitieve DPP4-remmer die de inactivering van de incretinehormonen vertraagt, waardoor hun bloedstroom wordt verhoogd concentraties en het verminderen van nuchtere en postprandiale glucoseconcentraties op een glucoseafhankelijke manier bij patiënten met diabetes type 2 mellitus.
farmacodynamiek
Bij patiënten met diabetes mellitus type 2 remt toediening van Onglyza de DPP4-enzymactiviteit gedurende een periode van 24 uur. Na een orale glucosebelasting of een maaltijd resulteerde deze DPP4-remming in een 2- tot 3-voudige toename van circulerende niveaus van actieve GLP-1 en GIP, verlaagde glucagonconcentraties en verhoogde glucose-afhankelijke insulinesecretie uit bètacellen van de pancreas. De toename van insuline en afname van glucagon werden geassocieerd met lagere nuchtere glucoseconcentraties en verminderde glucose-excursie na een orale glucosebelasting of een maaltijd.
Cardiale elektrofysiologie
In een gerandomiseerde, dubbelblinde, placebogecontroleerde, 4-weg crossover, actieve vergelijkende studie met moxifloxacine bij 40 gezonde proefpersonen, Onglyza werd niet geassocieerd met een klinisch betekenisvolle verlenging van het QTc-interval of de hartslag bij dagelijkse doses tot 40 mg (8 maal de MRHD).
farmacokinetiek
De farmacokinetiek van saxagliptine en zijn actieve metaboliet, 5-hydroxysaxagliptine, was vergelijkbaar bij gezonde proefpersonen en bij patiënten met diabetes mellitus type 2. De Cmax en AUC-waarden van saxagliptine en zijn actieve metaboliet namen evenredig toe in het dosisbereik van 2,5 tot 400 mg. Na een enkelvoudige orale dosis van 5 mg saxagliptine aan gezonde proefpersonen, waren de gemiddelde plasma-AUC-waarden voor saxagliptine en zijn actieve metaboliet respectievelijk 78 ng-h / ml en 214 ng-h / ml. Het overeenkomstige plasma Cmax waarden waren respectievelijk 24 ng / ml en 47 ng / ml. De gemiddelde variabiliteit (% CV) voor AUC en Cmax voor zowel saxagliptine als zijn actieve metaboliet was minder dan 25%.
Er werd geen merkbare accumulatie van saxagliptine of zijn actieve metaboliet waargenomen bij herhaalde eenmaal daagse dosering op elk dosisniveau. Er werd geen dosis- en tijdsafhankelijkheid waargenomen bij de klaring van saxagliptine en zijn actieve metaboliet gedurende 14 dagen eenmaal daagse dosering met saxagliptine in doses variërend van 2,5 tot 400 mg.
Absorptie
De mediane tijd tot maximale concentratie (Tmax) na de eenmaal daagse dosis van 5 mg was 2 uur voor saxagliptine en 4 uur voor zijn actieve metaboliet. Toediening met een vetrijke maaltijd resulteerde in een toename van de Tmax van saxagliptine ongeveer 20 minuten in vergelijking met nuchtere omstandigheden. Er was een toename van 27% in de AUC van saxagliptine bij toediening bij een maaltijd in vergelijking met nuchtere omstandigheden. Onglyza kan met of zonder voedsel worden toegediend.
Distributie
De in vitro eiwitbinding van saxagliptine en zijn actieve metaboliet in menselijk serum is verwaarloosbaar. Daarom wordt niet verwacht dat veranderingen in bloedproteïneniveaus in verschillende ziektetoestanden (bijv. Nier- of leverinsufficiëntie) de dispositie van saxagliptine zullen veranderen.
Metabolisme
Het metabolisme van saxagliptine wordt voornamelijk gemedieerd door cytochroom P450 3A4 / 5 (CYP3A4 / 5). De belangrijkste metaboliet van saxagliptine is ook een DPP4-remmer, die half zo krachtig is als saxagliptine. Daarom zullen sterke CYP3A4 / 5-remmers en inductoren de farmacokinetiek van saxagliptine en zijn actieve metaboliet veranderen. [Zien Geneesmiddelinteracties.]
afscheiding
Saxagliptine wordt geëlimineerd door zowel nier- als leverwegen. Na een enkele dosis van 50 mg 14C-saxagliptine, 24%, 36% en 75% van de dosis werd uitgescheiden in de urine als respectievelijk saxagliptine, de actieve metaboliet en totale radioactiviteit. De gemiddelde renale klaring van saxagliptine (~ 230 ml / min) was groter dan de gemiddelde geschatte glomerulaire filtratiesnelheid (~ 120 ml / min), hetgeen duidt op enige actieve renale excretie. Een totaal van 22% van de toegediende radioactiviteit werd teruggevonden in feces die de fractie van de dosis saxagliptine uitgescheiden in de gal en / of niet-geabsorbeerd geneesmiddel uit het maagdarmkanaal vertegenwoordigde. Na een enkelvoudige orale dosis Onglyza 5 mg voor gezonde personen, was de gemiddelde plasma-terminale halfwaardetijd (t1/2) voor saxagliptine en zijn actieve metaboliet was respectievelijk 2,5 en 3,1 uur.
Specifieke populaties
Nierinsufficiëntie
Een open-label onderzoek met een enkelvoudige dosis werd uitgevoerd om de farmacokinetiek van saxagliptine (dosis van 10 mg) te evalueren in personen met verschillende gradaties van chronische nierinsufficiëntie (N = 8 per groep) in vergelijking met personen met een normale nierfunctie functie. De studie omvatte patiënten met een nierfunctiestoornis geclassificeerd op basis van creatinineklaring als mild (> 50 tot â ‰ ¤80 ml / min), matig (30 tot â ‰ ¤50 ml / min) en ernstig (<30 ml / min), evenals patiënten met eindstadium nierziekte op hemodialyse. De creatinineklaring werd geschat op basis van serumcreatinine op basis van de Cockcroft-Gault-formule:
CrCl = [140 â age ’leeftijd (jaren)] × gewicht (kg) {× 0,85 voor vrouwelijke patiënten}
[72 × serum creatinine (mg / dL)]
De mate van nierinsufficiëntie had geen invloed op de Cmax van saxagliptine of zijn actieve metaboliet. Bij personen met een lichte nierfunctiestoornis waren de AUC-waarden van saxagliptine en zijn actieve metaboliet respectievelijk 20% en 70% hoger dan de AUC-waarden bij personen met een normale nierfunctie. Omdat verhogingen van deze omvang niet als klinisch relevant worden beschouwd, wordt aanpassing van de dosering bij patiënten met milde nierinsufficiëntie niet aanbevolen. Bij personen met matige of ernstige nierinsufficiëntie zijn de AUC-waarden van saxagliptine en zijn actieve metaboliet was respectievelijk 2,1- en 4,5-voudig hoger dan de AUC-waarden bij personen met een normale nierfunctie functie. Om de plasmablootstelling van saxagliptine en zijn actieve metaboliet te bereiken, vergelijkbaar met die bij patiënten met een normale nierfunctie, is de aanbevolen dosis is 2,5 mg eenmaal daags bij patiënten met matige en ernstige nierinsufficiëntie, evenals bij patiënten met een eindstadium nierziekte die vereist zijn hemodialyse. Saxagliptine wordt verwijderd door hemodialyse.
Leverinsufficiëntie
Bij personen met een leverfunctiestoornis (Child-Pugh-klassen A, B en C), gemiddelde Cmax en de AUC van saxagliptine waren respectievelijk tot 8% en 77% hoger in vergelijking met gezonde gematchte controles na toediening van een enkele dosis van 10 mg saxagliptine. De bijbehorende Cmax en AUC van de actieve metaboliet waren respectievelijk 59% en 33% lager in vergelijking met gezonde gematchte controles. Deze verschillen worden niet als klinisch relevant beschouwd. Er wordt geen dosisaanpassing aanbevolen voor patiënten met leverinsufficiëntie.
Body Mass Index
Er wordt geen dosisaanpassing aanbevolen op basis van de body mass index (BMI) die niet als significant werd geïdentificeerd covariate op de schijnbare klaring van saxagliptine of zijn actieve metaboliet in de farmacokinetische populatie analyse.
Geslacht
Er wordt geen dosisaanpassing aanbevolen op basis van geslacht. Er werden geen verschillen waargenomen in de farmacokinetiek van saxagliptine tussen mannen en vrouwen. In vergelijking met mannen hadden vrouwen ongeveer 25% hogere blootstellingswaarden voor de actieve metaboliet dan mannen, maar het is onwaarschijnlijk dat dit verschil van klinische relevantie is. Geslacht werd niet geïdentificeerd als een significant covariaat op de schijnbare klaring van saxagliptine en zijn actieve metaboliet in de populatie-farmacokinetische analyse.
geriatrisch
Er wordt geen dosisaanpassing aanbevolen op basis van alleen leeftijd. Oudere personen (65-80 jaar) hadden een geometrisch gemiddelde C met 23% en 59%max en geometrische gemiddelde AUC-waarden voor respectievelijk saxagliptine dan jonge personen (18-40 jaar). Verschillen in de actieve metaboliet farmacokinetiek tussen oudere en jonge proefpersonen weerspiegelden in het algemeen de verschillen die werden waargenomen in de farmacokinetiek van saxagliptine. Het verschil tussen de farmacokinetiek van saxagliptine en de actieve metaboliet bij jong en oud proefpersonen is waarschijnlijk te wijten aan meerdere factoren, waaronder afnemende nierfunctie en metabole capaciteit met toenemende leeftijd. Leeftijd werd niet geïdentificeerd als een significant covariaat op de schijnbare klaring van saxagliptine en zijn actieve metaboliet in de populatie-farmacokinetische analyse
Pediatric
Studies die de farmacokinetiek van saxagliptine karakteriseren bij pediatrische patiënten zijn niet uitgevoerd.
Ras en etniciteit
Er wordt geen dosisaanpassing aanbevolen op basis van ras. De populatie-farmacokinetische analyse vergeleek de farmacokinetiek van saxagliptine en zijn actieve metaboliet bij 309 blanke personen met 105 niet-blanke personen (bestaande uit zes rassen groepen). Er werd geen significant verschil in de farmacokinetiek van saxagliptine en zijn actieve metaboliet waargenomen tussen deze twee populaties.
Geneesmiddel-geneesmiddel interacties
In vitro beoordeling van geneesmiddelinteracties
Het metabolisme van saxagliptine wordt voornamelijk gemedieerd door CYP3A4 / 5.
In in vitro-onderzoeken remden saxagliptine en zijn actieve metaboliet CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 of 3A4 niet of induceerden CYP1A2, 2B6, 2C9 of 3A4. Daarom wordt niet verwacht dat saxagliptine de metabole klaring verandert van gelijktijdig toegediende geneesmiddelen die door deze enzymen worden gemetaboliseerd. Saxagliptine is een P-glycoproteïne (P-gp) substraat maar is geen significante remmer of inductor van P-gp.
De in vitro eiwitbinding van saxagliptine en zijn actieve metaboliet in menselijk serum is verwaarloosbaar. Derhalve zou eiwitbinding geen betekenisvolle invloed hebben op de farmacokinetiek van saxagliptine of andere geneesmiddelen.
In vivo beoordeling van geneesmiddelinteracties
Effecten van Saxagliptin op andere geneesmiddelen
In onderzoeken bij gezonde proefpersonen, zoals hieronder beschreven, veranderde saxagliptine de betekenis niet significant farmacokinetiek van metformine, glyburide, pioglitazon, digoxine, simvastatine, diltiazem of ketoconazol.
Metformine: Gelijktijdige toediening van een enkele dosis saxagliptine (100 mg) en metformine (1000 mg), een hOCT-2-substraat, veranderde de farmacokinetiek van metformine bij gezonde proefpersonen niet. Daarom is Onglyza geen remmer van door hOCT-2 gemedieerd transport.
Glyburide: Gelijktijdige toediening van een enkele dosis saxagliptine (10 mg) en glyburide (5 mg), een CYP2C9-substraat, verhoogde de plasma-Cmax van glyburide met 16%; de AUC van glyburide was echter onveranderd. Daarom remt Onglyza niet zinvol CYP2C9-gemedieerd metabolisme.
Pioglitazon: Gelijktijdige toediening van meerdere eenmaal daagse doses saxagliptine (10 mg) en pioglitazon (45 mg), een CYP2C8-substraat, verhoogde de plasma-Cmax van pioglitazon met 14%; de AUC van pioglitazon was echter onveranderd.
Digoxine: Gelijktijdige toediening van meerdere eenmaal daagse doses saxagliptine (10 mg) en digoxine (0,25 mg), een P-gp-substraat, veranderde de farmacokinetiek van digoxine niet. Daarom is Onglyza geen remmer of inductor van door P-gp gemedieerd transport.
Simvastatine: Gelijktijdige toediening van meerdere eenmaal daagse doses saxagliptine (10 mg) en simvastatine (40 mg), een CYP3A4 / 5-substraat, veranderde de farmacokinetiek van simvastatine niet. Daarom is Onglyza geen remmer of inductor van CYP3A4 / 5-gemedieerd metabolisme.
Diltiazem: gelijktijdige toediening van meerdere eenmaal daagse doses saxagliptine (10 mg) en diltiazem (360 mg langwerkende formulering in steady state), een matige remmer van CYP3A4 / 5, verhoogde de plasma-Cmax van diltiazem met 16%; de AUC van diltiazem was echter onveranderd.
Ketoconazol: Gelijktijdige toediening van een enkele dosis saxagliptine (100 mg) en meerdere doses ketoconazol (200 mg om de 12 uur bij steady-state), een sterke CYP3A4 / 5-remmer en P-gp, verlaagde de Cmax en AUC van ketoconazol in het plasma met 16% en 13%, respectievelijk.
Effecten van andere geneesmiddelen op Saxagliptin
Metformine: Gelijktijdige toediening van een enkele dosis saxagliptine (100 mg) en metformine (1000 mg), een hOCT-2-substraat, verlaagde de Cmax van saxagliptine met 21%; de AUC was echter onveranderd.
Glyburide: Gelijktijdige toediening van een enkele dosis saxagliptine (10 mg) en glyburide (5 mg), een CYP2C9-substraat, verhoogde de Cmax van saxagliptine met 8%; de AUC van saxagliptine was echter onveranderd.
Pioglitazon: gelijktijdige toediening van meerdere eenmaal daagse doses saxagliptine (10 mg) en pioglitazon (45 mg), een CYP2C8 (major) en CYP3A4 (minor) substraat, veranderde de farmacokinetiek van saxagliptine.
Digoxine: Gelijktijdige toediening van meerdere eenmaal daagse doses saxagliptine (10 mg) en digoxine (0,25 mg), een P-gp-substraat, veranderde de farmacokinetiek van saxagliptine niet.
Simvastatine: Gelijktijdige toediening van meerdere eenmaal daagse doses saxagliptine (10 mg) en simvastatine (40 mg), een CYP3A4 / 5-substraat, verhoogde de Cmax van saxagliptine met 21%; de AUC van saxagliptine was echter onveranderd.
Diltiazem: Gelijktijdige toediening van een enkele dosis saxagliptine (10 mg) en diltiazem (360 mg langwerkende formulering in steady state), een matige remmer van CYP3A4 / 5, verhoogde de Cmax van saxagliptine met 63% en de AUC met een factor 2,1. Dit ging gepaard met een overeenkomstige afname van de Cmax en AUC van de actieve metaboliet met respectievelijk 44% en 36%.
Ketoconazol: Gelijktijdige toediening van een enkele dosis saxagliptine (100 mg) en ketoconazol (200 mg elke 12 uur in steady state), een sterke remmer van CYP3A4 / 5 en P-gp, verhoogde de Cmax voor saxagliptine met 62% en de AUC met een factor 2,5. Dit ging gepaard met een overeenkomstige afname van de Cmax en AUC van de actieve metaboliet met respectievelijk 95% en 91%.
In een ander onderzoek verhoogde gelijktijdige toediening van een enkele dosis saxagliptine (20 mg) en ketoconazol (200 mg elke 12 uur in steady-state) de Cmax en AUC van saxagliptine met respectievelijk een factor 2,4 en 3,7. Dit ging gepaard met een overeenkomstige afname van de Cmax en AUC van de actieve metaboliet met respectievelijk 96% en 90%.
Rifampin: Gelijktijdige toediening van een enkele dosis saxagliptine (5 mg) en rifampin (600 mg QD bij steady-state) verlaagde de Cmax en AUC van saxagliptine met respectievelijk 53% en 76%, met een overeenkomstige toename in Cmax (39%) maar geen significante verandering in de plasma-AUC van de actieve metaboliet.
Omeprazol: Gelijktijdige toediening van meerdere eenmaal daagse doses saxagliptine (10 mg) en omeprazol (40 mg), een CYP2C19 (major) en CYP3A4-substraat, een remmer van CYP2C19 en een inductor van MRP-3, veranderden de farmacokinetiek van saxagliptine.
Aluminiumhydroxide + magnesiumhydroxide + simethicone: Gelijktijdige toediening van een enkele dosis saxagliptine (10 mg) en een vloeistof met aluminiumhydroxide (2400 mg), magnesiumhydroxide (2400 mg) en simethicone (240 mg) verlaagde de Cmax van saxagliptine met 26%; de AUC van saxagliptine was echter onveranderd.
Famotidine: toediening van een enkele dosis saxagliptine (10 mg) 3 uur na een enkele dosis famotidine (40 mg), een remmer van hOCT-1, hOCT-2 en hOCT-3 verhoogde de Cmax van saxagliptine met 14%; de AUC van saxagliptine was echter onveranderd.
top
Niet-klinische Toxicologie
Carcinogenese, mutagenese, aantasting van de vruchtbaarheid
Saxagliptine veroorzaakte geen tumoren in muizen (50, 250 en 600 mg / kg) of ratten (25, 75, 150 en 300 mg / kg) bij de hoogste geëvalueerde doses. De hoogste doses geëvalueerd bij muizen kwamen overeen met ongeveer 870 (mannen) en 1165 (vrouwen) maal de menselijke blootstelling bij de MRHD van 5 mg / dag. Bij ratten was de blootstelling ongeveer 355 (mannen) en 2217 (vrouwen) maal de MRHD.
Saxagliptine was niet mutageen of clastogeen met of zonder metabole activering in een in vitro Ames bacteriële test, een in vitro cytogenetica-test bij primaire menselijke lymfocyten, een in vivo orale micronucleustest bij ratten, een in vivo orale DNA-reparatiestudie bij ratten en een orale in vivo / in vitro cytogenetica-studie in perifeer bloed van ratten lymfocyten. De actieve metaboliet was niet mutageen in een in vitro Ames bacteriële test.
In een vruchtbaarheidsonderzoek bij ratten werden mannen gedurende 2 weken voorafgaand aan de paring, tijdens de paring en tot de geplande tijd behandeld met orale sondedoses. beëindiging (in totaal ongeveer 4 weken) en vrouwen werden behandeld met orale sondedoses gedurende 2 weken voorafgaand aan het paren via de zwangerschap dag 7. Er werden geen nadelige effecten op de vruchtbaarheid waargenomen bij blootstellingen van ongeveer 603 (mannen) en 776 (vrouwen) maal de MRHD. Hogere doses die maternale toxiciteit opwekten, verhoogden ook de foetale resorpties (ongeveer 2069 en 6138 keer de MRHD). Bijkomende effecten op oestrische cycli, vruchtbaarheid, ovulatie en implantatie werden waargenomen bij ongeveer 6138 keer de MRHD.
Diertoxicologie
Saxagliptine veroorzaakte nadelige huidveranderingen in de ledematen van cynomolgus-apen (korsten en / of zweren in de staart, cijfers, scrotum en / of neus). Huidlaesies waren omkeerbaar bij â ¥ 20 maal de MRHD, maar in sommige gevallen waren ze onomkeerbaar en necrotiserend bij hogere blootstellingen. Negatieve huidveranderingen werden niet waargenomen bij blootstellingen vergelijkbaar met (1 tot 3 keer) de MRHD van 5 mg. Klinische correlaties met huidletsels bij apen zijn niet waargenomen in klinische onderzoeken bij mensen met saxagliptine.
top
Klinische studies
Onglyza is onderzocht als monotherapie en in combinatie met metformine, glyburide en thiazolidinedione (pioglitazon en rosiglitazon) therapie. Onglyza is niet onderzocht in combinatie met insuline.
In totaal werden 4148 patiënten met diabetes mellitus type 2 gerandomiseerd in zes, dubbelblinde, gecontroleerde klinische onderzoeken die werden uitgevoerd om de veiligheid en glycemische werkzaamheid van Onglyza te evalueren. In totaal werden 3021 patiënten in deze onderzoeken behandeld met Onglyza. In deze onderzoeken was de gemiddelde leeftijd 54 jaar en 71% van de patiënten was blank, 16% was Aziatisch, 4% was zwart en 9% was van andere raciale groepen. Nog eens 423 patiënten, waaronder 315 die Onglyza kregen, namen deel aan een placebogecontroleerd dosisbereikonderzoek van 6 tot 12 weken.
In deze zes dubbelblinde onderzoeken werd Onglyza geëvalueerd bij doses van 2,5 mg en 5 mg eenmaal daags. Drie van deze onderzoeken evalueerden ook een dosis saxagliptine van 10 mg per dag. De dagelijkse dosis saxagliptine van 10 mg gaf geen grotere werkzaamheid dan de dagelijkse dosis van 5 mg. Behandeling met Onglyza bij alle doses veroorzaakte klinisch relevante en statistisch significante verbeteringen in hemoglobine A1c (A1C), nuchtere plasmaglucose (FPG) en 2 uur postprandiale glucose (PPG) na een standaard orale glucosetolerantietest (OGTT), vergeleken met controle. Verlagingen in A1C werden waargenomen in subgroepen zoals geslacht, leeftijd, ras en baseline BMI.
Onglyza werd niet geassocieerd met significante veranderingen ten opzichte van de uitgangswaarde in lichaamsgewicht of nuchtere serumlipiden vergeleken met placebo.
monotherapie
Een totaal van 766 patiënten met type 2 diabetes onvoldoende gecontroleerd op dieet en lichaamsbeweging (A1C â ‰ ¥ 7% tot â ‰ ¤10%) nam deel aan twee 24 weken durende, dubbelblinde, placebo-gecontroleerde onderzoeken ter evaluatie van de werkzaamheid en veiligheid van Onglyza monotherapie.
In de eerste studie, na een enkelblind dieet van 2 weken, lichaamsbeweging en placebo-inleidingsperiode, werden 401 patiënten gerandomiseerd naar 2,5 mg, 5 mg of 10 mg Onglyza of placebo. Patiënten die tijdens het onderzoek niet aan specifieke glycemische doelen voldeden, werden behandeld met metformine-reddingstherapie, toegevoegd aan placebo of Onglyza. De werkzaamheid werd geëvalueerd bij de laatste meting voorafgaand aan reddingstherapie voor patiënten die redding nodig hadden. Dosistitratie van Onglyza was niet toegestaan.
Behandeling met Onglyza 2,5 mg en 5 mg per dag gaf significante verbeteringen in A1C, FPG en PPG in vergelijking met placebo (tabel 3). Het percentage patiënten dat stopte wegens gebrek aan glycemische controle of die werden gered voor vooraf gespecificeerde ontmoeting glycemische criteria was 16% in de Onglyza-behandelingsgroep van 2,5 mg, 20% in de Onglyza-behandelingsgroep van 5 mg en 26% in de placebogroep.
Tabel 3: Glycemische parameters in week 24 in een placebogecontroleerde studie van Onglyza-monotherapie bij patiënten met diabetes type 2 *
| Werkzaamheidsparameter | Onglyza 2,5 mg N = 102 |
Onglyza 5 mg N = 106 |
Placebo N = 95 |
|---|---|---|---|
| * Intent-to-treat populatie met behulp van laatste observatie op studie of laatste observatie voorafgaand aan metformine-reddingstherapie voor patiënten die redding nodig hebben. | |||
| †Kleinste vierkanten gemiddelde gecorrigeerd voor basislijnwaarde. | |||
| c p-waarde <0,0001 vergeleken met placebo | |||
| § p-waarde <0,05 vergeleken met placebo | |||
| ¶ De significantie werd niet getest voor de PPG van 2 uur voor de dosis Onglyza van 2,5 mg. | |||
| Hemoglobine a1c (%) | N = 100 | N = 103 | N = 92 |
| Baseline (gemiddelde) | 7.9 | 8.0 | 7.9 |
| Verandering van baseline (aangepast gemiddelde†) | −0.4 | −0.5 | +0.2 |
| Verschil met placebo (aangepast gemiddelde†) | −0.6c | −0.6c | |
| 95% betrouwbaarheidsinterval | (−0.9, −0.3) | (−0.9, −0.4) | |
| Percentage patiënten dat A1C <7% bereikt | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Vastende plasmaglucose (mg / dL) | N = 101 | N = 105 | N = 92 |
| Baseline (gemiddelde) | 178 | 171 | 172 |
| Verandering van baseline (aangepast gemiddelde†) | −15 | −9 | +6 |
| Verschil met placebo (aangepast gemiddelde†) | −21 § | −15 § | |
| 95% betrouwbaarheidsinterval | (−31, −10) | (−25, −4) | |
| Postprandiale glucose 2 uur (mg / dL) | N = 78 | N = 84 | N = 71 |
| Baseline (gemiddelde) | 279 | 278 | 283 |
| Verandering van baseline (aangepast gemiddelde†) | −45 | −43 | −6 |
| Verschil met placebo (aangepast gemiddelde†) | −39 ¶ | −37 § | |
| 95% betrouwbaarheidsinterval | (−61, −16) | (−59, −15) |
Een tweede 24 weken durende monotherapie-studie werd uitgevoerd om een reeks doseringsschema's voor Onglyza te beoordelen. Behandelingsnaïeve patiënten met onvoldoende gecontroleerde diabetes (A1C â 7 ¥ 7% tot â ‰ ¤ 10%) ondergingen een 2 weken durend, enkelblind dieet, lichaamsbeweging en een placebo-inleidingsperiode. In totaal werden 365 patiënten gerandomiseerd naar 2,5 mg elke ochtend, 5 mg elke ochtend, 2,5 mg met mogelijke titratie tot 5 mg elke ochtend of 5 mg elke avond Onglyza of placebo. Patiënten die tijdens het onderzoek niet aan specifieke glycemische doelen voldeden, werden behandeld met metformine-reddingstherapie toegevoegd aan placebo of Onglyza; het aantal gerandomiseerde patiënten per behandelingsgroep varieerde van 71 tot 74.
Behandeling met Onglyza 5 mg elke ochtend of 5 mg elke avond leverde significante verbeteringen op in A1C versus placebo (gemiddelde placebo-gecorrigeerde verminderingen van respectievelijk âˆ'0,4% en âˆ'0,3%). Behandeling met Onglyza 2,5 mg elke ochtend leverde ook een significante verbetering op van A1C versus placebo (gemiddelde placebo-gecorrigeerde reductie van âˆ'0,4%).
Combinatietherapie
Add-on combinatietherapie met metformine
In totaal namen 743 patiënten met type 2 diabetes deel aan deze 24 weken durende, gerandomiseerde, dubbelblinde, placebo-gecontroleerde studie om de werkzaamheid en veiligheid van Onglyza in combinatie met metformine bij patiënten met onvoldoende glykemische controle (A1C â ‰ ¥ 7% en â ‰ ¤10%) op metformine alleen. Om in aanmerking te komen voor inschrijving, moesten patiënten gedurende ten minste 8 weken een stabiele dosis metformine (1500-2550 mg per dag) krijgen.
Patiënten die aan de geschiktheidscriteria voldeden, namen deel aan een single-blind, 2 weken durende, dieet- en oefen placebo-inleiding periode waarin patiënten metformine ontvingen in hun pre-onderzoeksdosis, tot 2500 mg per dag, gedurende de periode van studie. Na de inloopperiode werden in aanmerking komende patiënten gerandomiseerd naar 2,5 mg, 5 mg of 10 mg Onglyza of placebo naast hun huidige dosis open-label metformine. Patiënten die tijdens het onderzoek niet aan specifieke glycemische doelen voldeden, werden behandeld met pioglitazon-reddingstherapie, toegevoegd aan bestaande onderzoeksmedicijnen. Dosistitraties van Onglyza en metformine waren niet toegestaan.
Onglyza 2,5 mg en 5 mg add-on voor meformin zorgden voor significante verbeteringen in A1C, FPG en PPG in vergelijking met placebo-add-on voor metformine (tabel 4). Gemiddelde veranderingen ten opzichte van de basislijn voor A1C in de tijd en op het eindpunt worden getoond in figuur 1. Het aandeel patiënten dat stopte wegens gebrek aan glycemische controle of die werden gered omdat ze voldeden aan vooraf gespecificeerde glycemische criteria was 15% in de Onglyza 2,5 mg add-on voor metforminegroep, 13% in de Onglyza 5 mg add-on voor metforminegroep en 27% in de placebo-add-on voor metformine groep.
Tabel 4: Glycemische parameters in week 24 in een placebogecontroleerde studie van Onglyza als aanvullende combinatietherapie met metformine *
| Werkzaamheidsparameter | Onglyza 2,5 mg + metformine N = 192 |
Onglyza 5 mg + metformine N = 191 |
Placebo + metformine N = 179 |
|---|---|---|---|
| * Intent-to-treat populatie met behulp van laatste observatie op studie of laatste observatie voorafgaand aan pioglitazon rescue-therapie voor patiënten die moeten worden gered. | |||
| †Kleinste vierkanten gemiddelde gecorrigeerd voor basislijnwaarde. | |||
| c p-waarde <0,0001 vergeleken met placebo + metformine | |||
| § p-waarde <0,05 vergeleken met placebo + metformine | |||
| Hemoglobine a1c (%) | N = 186 | N = 186 | N = 175 |
| Baseline (gemiddelde) | 8.1 | 8.1 | 8.1 |
| Verandering van baseline (aangepast gemiddelde†) | −0.6 | −0.7 | +0.1 |
| Verschil met placebo (aangepast gemiddelde†) | −0.7c | −0.8c | |
| 95% betrouwbaarheidsinterval | (−0.9, −0.5) | (−1.0, −0.6) | |
| Percentage patiënten dat A1C <7% bereikt | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Vastende plasmaglucose (mg / dL) | N = 188 | N = 187 | N = 176 |
| Baseline (gemiddelde) | 174 | 179 | 175 |
| Verandering van baseline (aangepast gemiddelde†) | −14 | −22 | +1 |
| Verschil met placebo (aangepast gemiddelde†) | −16 § | −23 § | |
| 95% betrouwbaarheidsinterval | (−23, −9) | (−30, −16) | |
| Postprandiale glucose 2 uur (mg / dL) | N = 155 | N = 155 | N = 135 |
| Baseline (gemiddelde) | 294 | 296 | 295 |
| Verandering van baseline (aangepast gemiddelde†) | −62 | −58 | −18 |
| Verschil met placebo (aangepast gemiddelde†) | −44 § | −40 § | |
| 95% betrouwbaarheidsinterval | (−60, −27) | (−56, −24) |
Figuur 1: Gemiddelde verandering ten opzichte van de uitgangswaarde in A1C in een placebogecontroleerde studie van Onglyza als aanvullende combinatietherapie met metformine *

* Omvat patiënten met een basislijn en week 24-waarde.
Week 24 (LOCF) omvat de intent-to-treat populatie met behulp van de laatste observatie in het onderzoek voorafgaand aan pioglitazon rescue-therapie voor patiënten die moeten worden gered. Gemiddelde verandering ten opzichte van de basislijn wordt aangepast voor de basislijnwaarde.
Add-on combinatietherapie met een thiazolidinedion
In totaal namen 565 patiënten met type 2 diabetes deel aan deze 24 weken durende, gerandomiseerde, dubbelblinde, placebo-gecontroleerde studie om de werkzaamheid en veiligheid van Onglyza in combinatie met een thiazolidinedione (TZD) bij patiënten met onvoldoende glykemische controle (A1C â ‰ ¥ 7% tot â ‰ ¤10.5%) op TZD alleen. Om in aanmerking te komen voor inschrijving, moesten patiënten een stabiele dosis pioglitazon krijgen (eenmaal daags 30-45 mg) of rosiglitazon (4 mg eenmaal daags of 8 mg ofwel eenmaal daags of in twee verdeelde doses van 4 mg) voor minimaal 12 weken.
Patiënten die aan de geschiktheidscriteria voldeden, namen deel aan een enkelblind dieet van 2 weken en lichaamsbeweging placebo inloopperiode gedurende welke patiënten TZD kregen in hun pre-onderzoeksdosis voor de duur van de studie. Na de inloopperiode werden in aanmerking komende patiënten gerandomiseerd naar 2,5 mg of 5 mg Onglyza of placebo naast hun huidige dosis TZD. Patiënten die tijdens het onderzoek niet aan specifieke glycemische doelen voldeden, werden behandeld met metformine-redding, toegevoegd aan bestaande onderzoeksmedicijnen. Dosistitratie van Onglyza of TZD was tijdens het onderzoek niet toegestaan. Een verandering in het TZD-regime van rosiglitazon naar pioglitazon bij gespecificeerde, equivalente therapeutische doses was naar goeddunken van de onderzoeker toegestaan indien medisch relevant werd geacht.
Onglyza 2,5 mg en 5 mg add-on voor TZD zorgden voor significante verbeteringen in A1C, FPG en PPG in vergelijking met placebo-add-on voor TZD (tabel 5). Het deel van de patiënten dat stopte wegens gebrek aan glycemische controle of die werden gered vanwege het voldoen aan vooraf gespecificeerde glycemische criteria was 10% in de Onglyza 2,5 mg add-on voor de TZD-groep, 6% voor de Onglyza 5 mg add-on voor de TZD-groep en 10% in de placebo-add-on voor TZD groep.
Tabel 5: Glycemische parameters in week 24 in een placebogecontroleerde studie van Onglyza als aanvullende combinatietherapie met een thiazolidinedion *
| Werkzaamheidsparameter | Onglyza 2,5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
Placebo + TZD N = 184 |
|---|---|---|---|
| * Intent-to-treat populatie met behulp van laatste observatie op studie of laatste observatie voorafgaand aan metformine-reddingstherapie voor patiënten die redding nodig hebben. | |||
| †Kleinste vierkanten gemiddelde gecorrigeerd voor basislijnwaarde. | |||
| c p-waarde <0,0001 vergeleken met placebo + TZD | |||
| § p-waarde <0,05 vergeleken met placebo + TZD | |||
| Hemoglobine a1c (%) | N = 192 | N = 183 | N = 180 |
| Baseline (gemiddelde) | 8.3 | 8.4 | 8.2 |
| Verandering van baseline (aangepast gemiddelde†) | −0.7 | −0.9 | −0.3 |
| Verschil met placebo (aangepast gemiddelde†) | −0.4 § | −0.6c | |
| 95% betrouwbaarheidsinterval | (−0.6, −0.2) | (−0.8, −0.4) | |
| Percentage patiënten dat A1C <7% bereikt | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Vastende plasmaglucose (mg / dL) | N = 193 | N = 185 | N = 181 |
| Baseline (gemiddelde) | 163 | 160 | 162 |
| Verandering van baseline (aangepast gemiddelde†) | −14 | −17 | −3 |
| Verschil met placebo (aangepast gemiddelde†) | −12 § | −15 § | |
| 95% betrouwbaarheidsinterval | (−20, −3) | (−23, −6) | |
| Postprandiale glucose 2 uur (mg / dL) | N = 156 | N = 134 | N = 127 |
| Baseline (gemiddelde) | 296 | 303 | 291 |
| Verandering van baseline (aangepast gemiddelde†) | −55 | −65 | −15 |
| Verschil met placebo (aangepast gemiddelde†) | −40 § | −50 § | |
| 95% betrouwbaarheidsinterval | (−56, −24) | (−66, −34) |
Add-on combinatietherapie met glyburide
In totaal namen 768 patiënten met type 2 diabetes deel aan deze 24 weken durende, gerandomiseerde, dubbelblinde, placebo-gecontroleerde studie om de werkzaamheid en veiligheid te evalueren van Onglyza in combinatie met een sulfonylureum (SU) bij patiënten met onvoldoende glykemische controle bij inschrijving (A1C â ‰ ¥ 7,5% tot â ‰ ¤10%) op een submaximale dosis SU alleen. Om in aanmerking te komen voor inschrijving, moesten patiënten een submaximale dosis SU gedurende 2 maanden of meer krijgen. In deze studie werd Onglyza in combinatie met een vaste, tussentijdse dosis SU vergeleken met titratie tot een hogere dosis SU.
Patiënten die aan de geschiktheidscriteria voldeden, namen deel aan een single-blind, 4 weken durende voedings- en trainingsperiode en werden eenmaal daags op 7,5 mg glyburide geplaatst. Na de inloopperiode werden in aanmerking komende patiënten met A1C â ‰ ¥ 7% tot â ‰ ¤10% gerandomiseerd naar 2,5 mg of 5 mg Onglyza add-on voor 7,5 mg glyburide of placebo plus een totale dagelijkse dosis van 10 mg Glyburide. Patiënten die placebo kregen, kwamen in aanmerking om glyburide te laten titreren tot een totale dagelijkse dosis van 15 mg. Up-titratie van glyburide was niet toegestaan bij patiënten die 2,5 mg of 5 mg Onglyza kregen. Glyburide kan in elke behandelingsgroep eenmaal tijdens de onderzoeksperiode van 24 weken worden verlaagd als gevolg van hypoglykemie, zoals door de onderzoeker noodzakelijk wordt geacht. Ongeveer 92% van de patiënten in de placebo- en glyburidegroep werd tijdens de eerste 4 weken van de studieperiode verhoogd tot een totale einddosis van 15 mg. Patiënten die tijdens het onderzoek niet aan specifieke glycemische doelen voldeden, werden behandeld met metformine-redding, toegevoegd aan bestaande onderzoeksmedicatie. Dosistitratie van Onglyza was tijdens het onderzoek niet toegestaan.
In combinatie met glyburide zorgden Onglyza 2,5 mg en 5 mg voor significante verbeteringen in A1C, FPG en PPG in vergelijking met de placebo plus verhoogde titulatiegroep (tabel 6). Het aandeel patiënten dat stopte wegens gebrek aan glycemische controle of die werden gered omdat ze voldeden aan vooraf gespecificeerde glycemische criteria was 18% in de Onglyza 2,5 mg add-on voor glyburidegroep, 17% in de Onglyza 5 mg add-on voor glyburidegroep en 30% in de placebo plus getitreerde glyburide groep.
Tabel 6: Glycemische parameters in week 24 in een placebogecontroleerde studie van Onglyza als aanvullende combinatietherapie met Glyburide *
| Werkzaamheidsparameter | Onglyza 2,5 mg + glyburide 7,5 mg N = 248 |
Onglyza 5 mg + glyburide 7,5 mg N = 253 |
Placebo + Opgetiterde Glyburide N = 267 |
|---|---|---|---|
| * Intent-to-treat populatie met behulp van laatste observatie op studie of laatste observatie voorafgaand aan metformine-reddingstherapie voor patiënten die redding nodig hebben. | |||
| †Kleinste vierkanten gemiddelde gecorrigeerd voor basislijnwaarde. | |||
| c p-waarde <0,0001 vergeleken met placebo + verhoogd titratie glyburide | |||
| § p-waarde <0,05 vergeleken met placebo + getitreerd glyburide | |||
| Hemoglobine a1c (%) | N = 246 | N = 250 | N = 264 |
| Baseline (gemiddelde) | 8.4 | 8.5 | 8.4 |
| Verandering van baseline (aangepast gemiddelde†) | −0.5 | −0.6 | +0.1 |
| Verschil ten opzichte van getitreerd glyburide (aangepast gemiddelde†) | −0.6c | −0.7c | |
| 95% betrouwbaarheidsinterval | (−0.8, −0.5) | (−0.9, −0.6) | |
| Percentage patiënten dat A1C <7% bereikt | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Vastende plasmaglucose (mg / dL) | N = 247 | N = 252 | N = 265 |
| Baseline (gemiddelde) | 170 | 175 | 174 |
| Verandering van baseline (aangepast gemiddelde†) | −7 | −10 | +1 |
| Verschil ten opzichte van getitreerd glyburide (aangepast gemiddelde†) | −8 § | −10 § | |
| 95% betrouwbaarheidsinterval | (−14, −1) | (−17, −4) | |
| Postprandiale glucose 2 uur (mg / dL) | N = 195 | N = 202 | N = 206 |
| Baseline (gemiddelde) | 309 | 315 | 323 |
| Verandering van baseline (aangepast gemiddelde†) | −31 | −34 | +8 |
| Verschil ten opzichte van getitreerd glyburide (aangepast gemiddelde†) | −38 § | −42 § | |
| 95% betrouwbaarheidsinterval | (−50, −27) | (−53, −31) |
Gelijktijdige toediening met metformine bij behandelingsnaïeve patiënten
In totaal namen 1306 behandelingsnaïeve patiënten met diabetes mellitus type 2 deel aan deze 24 weken durende, gerandomiseerde, dubbelblinde, placebo-gecontroleerde studie om evalueren van de werkzaamheid en veiligheid van Onglyza gelijktijdig toegediend met metformine bij patiënten met onvoldoende glykemische controle (A1C â ‰ ¥ 8% tot â ‰ ¤ 12%) op dieet en lichaamsbeweging alleen. Patiënten moesten behandelingsnaïef zijn om aan dit onderzoek te kunnen deelnemen.
Patiënten die aan de geschiktheidscriteria voldeden, namen deel aan een periode van één blind, 1 week diëten met voeding en lichaamsbeweging met placebo. Patiënten werden gerandomiseerd naar een van de vier behandelingsgroepen: Onglyza 5 mg + metformine 500 mg, saxagliptine 10 mg + metformine 500 mg, saxagliptine 10 mg + placebo of metformine 500 mg + placebo. Onglyza werd eenmaal daags gedoseerd. In de 3 behandelingsgroepen die metformine gebruikten, werd de dosis metformine wekelijks verhoogd in stappen van 500 mg per dag, zoals getolereerd, tot een maximum van 2000 mg per dag op basis van FPG. Patiënten die tijdens de onderzoeken niet aan specifieke glycemische doelen voldeden, werden behandeld met pioglitazon rescue als aanvullende therapie.
Gelijktijdige toediening van Onglyza 5 mg plus metformine zorgde voor significante verbeteringen in A1C, FPG en PPG in vergelijking met placebo plus metformine (tabel 7).
Tabel 7: Glycemische parameters in week 24 in een placebogecontroleerde studie van gelijktijdige toediening van Onglyza met metformine bij behandelingsnaïeve patiënten
| Werkzaamheidsparameter | Onglyza 5 mg + metformine N = 320 |
Placebo + metformine N = 328 |
|---|---|---|
| * Intent-to-treat populatie met behulp van laatste observatie op studie of laatste observatie voorafgaand aan pioglitazon rescue-therapie voor patiënten die moeten worden gered. | ||
| †Kleinste vierkanten gemiddelde gecorrigeerd voor basislijnwaarde. | ||
| c p-waarde <0,0001 vergeleken met placebo + metformine | ||
| § p-waarde <0,05 vergeleken met placebo + metformine | ||
| Hemoglobine a1c (%) | N = 306 | N = 313 |
| Baseline (gemiddelde) | 9.4 | 9.4 |
| Verandering van baseline (aangepast gemiddelde†) | −2.5 | −2.0 |
| Verschil met placebo + metformine (aangepast gemiddelde†) | −0.5c | |
| 95% betrouwbaarheidsinterval | (−0.7, −0.4) | |
| Percentage patiënten dat A1C <7% bereikt | 60% §(185/307) | 41% (129/314) |
| Vastende plasmaglucose (mg / dL) | N = 315 | N = 320 |
| Baseline (gemiddelde) | 199 | 199 |
| Verandering van baseline (aangepast gemiddelde†) | −60 | −47 |
| Verschil met placebo + metformine (aangepast gemiddelde†) | −13 § | |
| 95% betrouwbaarheidsinterval | (−19, −6) | |
| Postprandiale glucose 2 uur (mg / dL) | N = 146 | N = 141 |
| Baseline (gemiddelde) | 340 | 355 |
| Verandering van baseline (aangepast gemiddelde†) | −138 | −97 |
| Verschil met placebo + metformine (aangepast gemiddelde†) | −41 § | |
| 95% betrouwbaarheidsinterval | (−57, −25) |
top
Hoe geleverd
Onglyza ™ (saxagliptine) tabletten hebben markeringen aan beide zijden en zijn verkrijgbaar in de sterktes en verpakkingen vermeld in Tabel 8.
| Tablet Sterkte |
Filmomhulde tablet Color / Shape |
Tablet markeringen |
Pakketgrootte | NDC-code |
|---|---|---|---|---|
| 5 mg | roze biconvex, rond |
"5" aan de ene zijde en "4215" aan de achterzijde, in blauwe inkt | Flessen van 30 Flessen van 90 Flessen van 500 Blister van 100 |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | lichtgeel tot lichtgeel biconvex, rond |
"2.5" aan de ene zijde en "4214" aan de achterzijde, in blauwe inkt | Flessen van 30 Flessen van 90 |
0003-4214-11 0003-4214-21 |
Opslag en gebruik
Bewaren bij 20 ° -25 ° C (68 ° -77 ° F); excursies toegestaan tot 15 ° -30 ° C (59 ° -86 ° F) [zie USP Gecontroleerde kamertemperatuur].
top
Laatst bijgewerkt: 07/09
E.R. Squibb & Sons, L.L.C.
Onglyza patiëntinformatie
Gedetailleerde informatie over tekenen, symptomen, oorzaken, behandelingen van diabetes
De informatie in deze monografie is niet bedoeld om alle mogelijke toepassingen, aanwijzingen, voorzorgsmaatregelen, interacties tussen geneesmiddelen of bijwerkingen te dekken. Deze informatie is algemeen en is niet bedoeld als specifiek medisch advies. Neem contact op met uw arts, apotheker of verpleegkundige als u vragen heeft over de medicijnen die u gebruikt of meer informatie wilt.
terug naar: Blader door alle medicijnen voor diabetes

