Namenda: Alzheimer's Medication
Namenda is een medicijn dat wordt gebruikt bij de behandeling van de ziekte van Alzheimer. Gedetailleerde informatie over gebruik, dosering, bijwerkingen van Namenda.
Merknaam: Namenda
Generieke naam: Memantine hydrochloride
Namenda (memantinehydrochloride) is een medicijn dat wordt gebruikt bij de behandeling van de ziekte van Alzheimer. Gedetailleerde informatie over gebruik, dosering en bijwerkingen van Namenda hieronder.
Inhoud:
Beschrijving
farmacologie
Aanwijzingen en gebruik
Contra
Voorzorgsmaatregelen
Geneesmiddelinteracties
Bijwerkingen
Overdose
Dosering
Geleverde
Instructies voor de patiënt
Namenda-patiëntinformatie (in gewoon Engels)
Beschrijving
Namenda® (memantinehydrochloride) is een oraal actieve NMDA-receptorantagonist. De chemische naam voor memantinehydrochloride is 1-amino-3,5-dimethyladamantaanhydrochloride met de volgende structuurformule:
Bron: Forest Laboratories, Amerikaanse distributeur of Namenda.
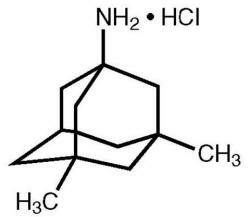
De molecuulformule is C12H21N.Cl en het molecuulgewicht is 215,76.
Memantine HCl treedt op als een fijn wit tot gebroken wit poeder en is oplosbaar in water. Namenda is beschikbaar als tabletten of als een orale oplossing. Namenda is beschikbaar voor orale toediening als capsulevormige, filmomhulde tabletten die 5 mg en 10 mg memantinehydrochloride bevatten. De tabletten bevatten ook de volgende inactieve ingrediënten: microkristallijne cellulose, lactosemonohydraat, colloïdaal siliciumdioxide, talk en magnesiumstearaat. Bovendien zijn de volgende inactieve ingrediënten ook aanwezig als componenten van de filmlaag: hypromellose, triacetine, titaniumdioxide, FD&C geel # 6 en FD&C blauw # 2 (tabletten van 5 mg), zwart ijzeroxide (tabletten van 10 mg). Namenda drank bevat memantinehydrochloride in een sterkte die overeenkomt met 2 mg memantinehydrochloride in elke ml. De drank bevat ook de volgende inactieve ingrediënten: sorbitol-oplossing (70%), methylparaben, propylparaben, propyleenglycol, glycerine, natuurlijke pepermuntsmaak # 104, citroenzuur, natriumcitraat en gezuiverd water.
Klinische Farmacologie
Werkingsmechanisme en farmacodynamiek
Aanhoudende activering van N-methyl-D-aspartaat (NMDA) -receptoren van het centrale zenuwstelsel door de van prikkelend aminozuur glutamaat wordt verondersteld dat het bijdraagt aan de symptomatologie van Ziekte van Alzheimer. Er wordt verondersteld dat Memantine zijn therapeutische effect uitoefent door zijn werking als een lage tot matige affiniteit niet-competitieve (open kanaal) NMDA-receptorantagonist die bij voorkeur bindt aan de door de NMDA-receptor bediende kationkanalen. Er zijn geen aanwijzingen dat memantine neurodegeneratie voorkomt of vertraagt bij patiënten met de ziekte van Alzheimer.
Memantine vertoonde een lage tot verwaarloosbare affiniteit voor GABA-, benzodiazepine-, dopamine-, adrenerge, histamine- en glycinereceptoren en voor spanningsafhankelijke Ca2 +, Na + of K + kanalen. Memantine vertoonde ook antagonistische effecten op de 5HT3-receptor met een potentie vergelijkbaar met die voor de NMDA-receptor en geblokkeerde nicotine-acetylcholinereceptoren met een zesde tot een tiende van de potentie.
In vitro-onderzoeken hebben aangetoond dat memantine de omkeerbare remming van acetylcholinesterase door donepezil, galantamine of tacrine niet beïnvloedt.
farmacokinetiek
Memantine wordt goed geabsorbeerd na orale toediening en heeft lineaire farmacokinetiek over het therapeutische dosisbereik. Het wordt voornamelijk uitgescheiden in de urine, ongewijzigd en heeft een terminale eliminatiehalfwaardetijd van ongeveer 60-80 uur.
Absorptie en distributie
Na orale toediening wordt memantine sterk geabsorbeerd met piekconcentraties die binnen ongeveer 3-7 uur worden bereikt. Voedsel heeft geen effect op de absorptie van memantine. Het gemiddelde distributievolume van memantine is 9-11 L / kg en de plasma-eiwitbinding is laag (45%).
Metabolisme en eliminatie
Memantine ondergaat een gedeeltelijk levermetabolisme. Ongeveer 48% van het toegediende geneesmiddel wordt onveranderd uitgescheiden in de urine; de rest wordt primair omgezet in drie polaire metabolieten die een minimale NMDA-receptor bezitten antagonistische activiteit: het N-glucuronide conjugaat, 6-hydroxy memantine en 1-nitroso-gedeamineerd memantine. Een totaal van 74% van de toegediende dosis wordt uitgescheiden als de som van het oudergeneesmiddel en het N-glucuronide-conjugaat. Het hepatische microsomale CYP450-enzymsysteem speelt geen significante rol in het metabolisme van memantine. Memantine heeft een terminale eliminatiehalfwaardetijd van ongeveer 60-80 uur. Nierklaring omvat actieve tubulaire secretie gemodereerd door pH-afhankelijke tubulaire reabsorptie.
Speciale populaties
Nierinsufficiëntie: De farmacokinetiek van Memantine werd geëvalueerd na eenmalige orale toediening van 20 mg memantine HCl bij 8 personen met milde nierinsufficiëntie (creatinineklaring, CLcr,> 50 - 80 ml / min), 8 personen met matige nierinsufficiëntie (CLcr 30 - 49 ml / min), 7 personen met ernstige nierinsufficiëntie (CLcr 5 - 29 ml / min) en 8 gezonde proefpersonen (CLcr> 80 ml / min) kwamen qua leeftijd, gewicht en geslacht zo goed mogelijk overeen met de personen met nierfunctie impairment. De gemiddelde AUC 0- (oneindig) steeg met respectievelijk 4%, 60% en 115% bij personen met een lichte, matige en ernstige nierfunctiestoornis in vergelijking met gezonde personen. De terminale eliminatiehalfwaardetijd nam met respectievelijk 18%, 41% en 95% toe bij personen met milde, matige en ernstige nierfunctiestoornis in vergelijking met gezonde personen.
Er wordt geen dosisaanpassing aanbevolen voor patiënten met milde en matige nierinsufficiëntie. De dosering moet worden verlaagd bij patiënten met ernstige nierinsufficiëntie (zie DOSERING EN TOEDIENING).
ouderen: De farmacokinetiek van Namenda bij jonge en oudere personen is vergelijkbaar.
Geslacht: Na toediening van meerdere doses Namenda 20 mg b.i.d. hadden vrouwen ongeveer 45% hogere blootstelling dan mannen, maar er was geen verschil in blootstelling wanneer rekening werd gehouden met het lichaamsgewicht.
Geneesmiddel-geneesmiddel interacties
Substraten van microsomale enzymen: In-vitro-onderzoeken gaven aan dat bij concentraties die hoger zijn dan die geassocieerd met de werkzaamheid, memantine de cytochroom P450-isozymen CYP1A2, CYP2C9, CYP2E1 en CYP3A4 / 5 niet induceert. Bovendien hebben in vitro onderzoeken aangetoond dat memantine minimale remming van CYP450-enzymen CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1 en CYP3A4 veroorzaakt. Deze gegevens geven aan dat geen farmacokinetische interacties worden verwacht met geneesmiddelen die door deze enzymen worden gemetaboliseerd.
Remmers van microsomale enzymen: Aangezien memantine een minimaal metabolisme ondergaat, waarbij het grootste deel van de dosis onveranderd in de urine wordt uitgescheiden, is een interactie tussen memantine en geneesmiddelen die CYP450-enzymen remmen, onwaarschijnlijk. Gelijktijdige toediening van Namenda met de AChE-remmer donepezil HCl heeft geen invloed op de farmacokinetiek van beide verbindingen.
Geneesmiddelen geëlimineerd via niermechanismen: Memantine wordt gedeeltelijk geëlimineerd door tubulaire secretie. In vivo studies hebben aangetoond dat meerdere doses van het diureticum hydrochloorthiazide / triamtereen (HCTZ / TA) geen invloed hadden op de AUC van memantine in steady state. Memantine had geen invloed op de biologische beschikbaarheid van TA en verlaagde de AUC en Cmax van HCTZ met ongeveer 20%. Gelijktijdige toediening van memantine met het antihyperglycemische geneesmiddel Glucovance® (glyburide en metformine HCl) had geen invloed op de farmacokinetiek van memantine, metformine en glyburide. Memantine heeft de serumglucoseverlagende effecten van Glucovance® niet gewijzigd, wat wijst op de afwezigheid van een farmacodynamische interactie.
Geneesmiddelen die de urine basisch maken: De klaring van memantine was verminderd met ongeveer 80% onder alkalische urine-omstandigheden bij pH 8. Daarom kunnen veranderingen van de pH van de urine in de richting van de alkalische toestand leiden tot een ophoping van het medicijn met een mogelijke toename van bijwerkingen. Van geneesmiddelen die de urine alkaliseren (bijv. Koolzuuranhydraseremmers, natriumbicarbonaat) wordt verwacht dat ze de renale eliminatie van memantine verminderen.
Geneesmiddelen sterk gebonden aan plasma-eiwitten: Omdat de plasma-eiwitbinding van memantine laag is (45%), is een interactie met geneesmiddelen die sterk gebonden zijn aan plasma-eiwitten, zoals warfarine en digoxine, onwaarschijnlijk.
KLINISCHE PROEVEN
De effectiviteit van Namenda (memantinehydrochloride) als een behandeling voor patiënten met matige tot ernstige ziekte van Alzheimer werd aangetoond in 2 gerandomiseerde, dubbelblinde, placebo-gecontroleerde klinische studies (studies 1 en 2) uitgevoerd in de Verenigde Staten waarin zowel de cognitieve functie als de dagelijkse functie werden beoordeeld. De gemiddelde leeftijd van patiënten die aan deze twee onderzoeken deelnamen was 76 met een bereik van 50-93 jaar. Ongeveer 66% van de patiënten was vrouw en 91% van de patiënten was blank.
Een derde studie (studie 3), uitgevoerd in Letland, omvatte patiënten met ernstige dementie, maar beoordeelde de cognitieve functie niet als een gepland eindpunt.
Onderzoeksresultaten: in elk Amerikaans onderzoek werd de effectiviteit van Namenda bepaald met behulp van beide instrumenten ontworpen om de algehele functie te evalueren door middel van zorgverlener-gerelateerde beoordeling, en een instrument dat meet cognitie. Beide studies toonden aan dat patiënten op Namenda een significante verbetering van beide maatregelen ervoeren in vergelijking met placebo.
De dagelijkse functie werd in beide studies beoordeeld met behulp van de gemodificeerde Alzheimer-coöperatieve studie - Activiteiten van dagelijks leven inventaris (ADCS-ADL). De ADCS-ADL bestaat uit een uitgebreide reeks ADL-vragen die worden gebruikt om de functionele mogelijkheden van patiënten te meten. Elk ADL-item wordt beoordeeld op het hoogste niveau van onafhankelijke prestaties om het verlies te voltooien. De onderzoeker voert de inventarisatie uit door een zorgverlener te interviewen die bekend is met het gedrag van de patiënt. Een subset van 19 items, waaronder beoordelingen van het vermogen van de patiënt om te eten, kleden, baden, telefoon, reizen, winkelen, en andere huishoudelijke taken uitvoeren is gevalideerd voor de beoordeling van patiënten met matige tot ernstige Dementie. Dit is de gemodificeerde ADCS-ADL, met een scorebereik van 0 tot 54, waarbij de lagere scores wijzen op een grotere functionele beperking.
Het vermogen van Namenda om de cognitieve prestaties te verbeteren werd in beide onderzoeken beoordeeld met de Severe Impairment Battery (SIB), een multi-item instrument dat is gevalideerd voor de evaluatie van cognitieve functie bij patiënten met matige tot ernstige Dementie. De SIB onderzoekt geselecteerde aspecten van cognitieve prestaties, waaronder elementen van aandacht, oriëntatie, taal, geheugen, visueel-ruimtelijke vaardigheden, constructie, praktijk en sociale interactie. Het SIB-scorebereik is van 0 tot 100, waarbij lagere scores wijzen op een grotere cognitieve stoornis.
Studie 1 (studie van achtentwintig weken)
In een studie van 28 weken, 252 patiënten met matige tot ernstige waarschijnlijke ziekte van Alzheimer (gediagnosticeerd door DSM-IV en NINCDS-ADRDA criteria, met Mini-Mental State Examen scores> / = 3 en! - = 14 en Global Deterioration Scale Stages 5-6) werden gerandomiseerd naar Namenda of placebo. Voor patiënten gerandomiseerd naar Namenda werd de behandeling gestart met 5 mg eenmaal daags en wekelijks verhoogd met 5 mg / dag in verdeelde doses tot een dosis van 20 mg / dag (10 mg tweemaal daags).
Effecten op de ADCS-ADL:
Figuur 1 toont het tijdsverloop voor de verandering van de uitgangswaarde in de ADCS-ADL-score voor patiënten in de twee behandelingsgroepen die de 28 weken van de studie voltooiden. Na 28 weken behandeling was het gemiddelde verschil in de ADCS-ADL-veranderingsscores voor de met Namenda behandelde patiënten in vergelijking met de patiënten die placebo kregen 3,4 eenheden. Met behulp van een analyse op basis van alle patiënten en hun laatste studieobservatie vooruit (LOCF-analyse) was de behandeling met Namenda statistisch significant beter dan placebo.
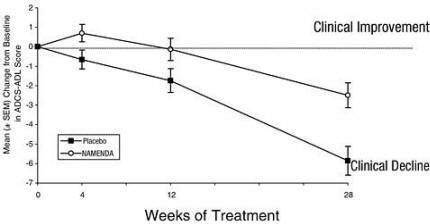
Figuur 1: Tijdsverloop van de verandering van de uitgangswaarde in de ADCS-ADL-score voor patiënten die 28 weken behandeling hebben voltooid.
Figuur 2 toont de cumulatieve percentages van patiënten uit elk van de behandelingsgroepen die ten minste de verandering in de ADCS-ADL op de X-as hadden bereikt.
De curven laten zien dat beide aan Namenda en placebo toegewezen patiënten een breed scala aan responsen hebben en in het algemeen achteruitgang vertonen (a negatieve verandering in ADCS-ADL vergeleken met baseline), maar dat de Namenda-groep eerder een kleinere daling of een lagere verbetering. (In een cumulatieve distributieweergave zou een curve voor een effectieve behandeling naar links van de curve worden verschoven placebo, terwijl een ineffectieve of schadelijke behandeling zou worden gesuperponeerd of naar rechts van de curve zou worden verplaatst voor placebo.)
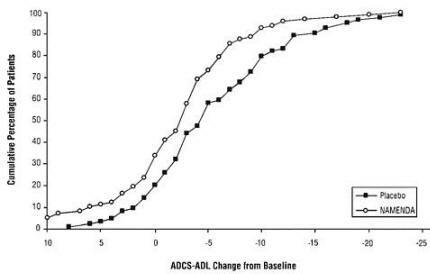
Figuur 2: Cumulatief percentage patiënten dat 28 weken dubbelblinde behandeling voltooide met gespecificeerde veranderingen ten opzichte van de uitgangswaarde in ADCS-ADL-scores.
Effecten op de SIB: Figuur 3 toont het tijdsverloop voor de verandering van baseline in SIB-score voor de twee behandelingsgroepen gedurende de 28 weken van de studie. Na 28 weken behandeling was het gemiddelde verschil in de SIB-veranderingsscores voor de met Namenda behandelde patiënten vergeleken met de patiënten die placebo kregen 5,7 eenheden. Met behulp van een LOCF-analyse was de behandeling met Namenda statistisch significant beter dan placebo.

Figuur 3: Tijdsverloop van de verandering van de uitgangswaarde in SIB-score voor patiënten die 28 weken behandeling hebben voltooid.
Figuur 4 toont de cumulatieve percentages van patiënten uit elke behandelingsgroep die ten minste de mate van verandering in SIB-score op de X-as hadden bereikt.
De curven laten zien dat beide patiënten die zijn toegewezen aan Namenda en placebo een breed scala aan responsen hebben en vertonen over het algemeen verslechtering, maar dat de Namenda-groep eerder een kleinere daling of een verbetering.
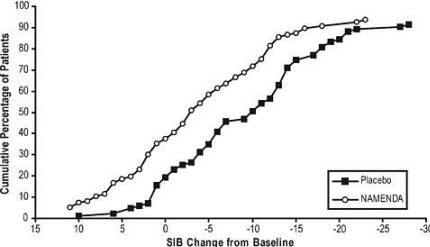
Figuur 4: Cumulatief percentage patiënten dat 28 weken dubbelblinde behandeling voltooide met gespecificeerde veranderingen ten opzichte van de uitgangssituatie in SIB-scores.
Onderzoek 2 (onderzoek van vierentwintig weken) In een onderzoek van 24 weken duurden 404 patiënten met matige tot ernstige waarschijnlijke ziekte van Alzheimer (gediagnosticeerd door NINCDS-ADRDA-criteria, met mini-mentaal onderzoek scores ≥ 5 en ≤ 14) die minstens 6 maanden met donepezil zijn behandeld en die een stabiele dosis van donepezil voor de laatste 3 maanden werden gerandomiseerd naar Namenda of placebo terwijl het nog steeds werd ontvangen donepezil. Voor patiënten gerandomiseerd naar Namenda werd de behandeling gestart met 5 mg eenmaal daags en wekelijks verhoogd met 5 mg / dag in verdeelde doses tot een dosis van 20 mg / dag (10 mg tweemaal daags).
Effecten op de ADCS-ADL: Figuur 5 toont het tijdsverloop voor de verandering van baseline in de ADCS-ADL-score voor de twee behandelingsgroepen gedurende de 24 weken van de studie. Na 24 weken behandeling was het gemiddelde verschil in de ADCS-ADL-veranderingsscores voor de Namenda / donepezil behandelde patiënten (combinatietherapie) vergeleken met de patiënten die placebo / donepezil (monotherapie) kregen was 1,6 units. Met behulp van een LOCF-analyse was de behandeling met Namenda / donepezil statistisch significant beter dan placebo / donepezil.

Figuur 5: Tijdsverloop van de verandering ten opzichte van de uitgangswaarde in de ADCS-ADL-score voor patiënten die 24 weken behandeling hebben voltooid.
Figuur 6 toont de cumulatieve percentages van patiënten uit elk van de behandelingsgroepen die ten minste de mate van verbetering hadden bereikt in de ADCS-ADL getoond op de X-as.
De curven laten zien dat beide patiënten toegewezen aan Namenda / donepezil en placebo / donepezil een breed scala aan responsen hebben en vertonen over het algemeen verslechtering, maar dat de Namenda / donepezil-groep eerder een kleinere achteruitgang of een verbetering.

Figuur 6: Cumulatief percentage patiënten dat 24 weken dubbelblinde behandeling met gespecificeerde veranderingen ten opzichte van baseline in ADCS-ADL-scores voltooit.
Effecten op de SIB: Figuur 7 toont het tijdsverloop voor de verandering van baseline in SIB-score voor de twee behandelingsgroepen gedurende de 24 weken van de studie. Na 24 weken behandeling was het gemiddelde verschil in de SIB-veranderingsscores voor de met Namenda / donepezil behandelde patiënten vergeleken met de patiënten die placebo / donepezil kregen 3,3 eenheden. Met behulp van een LOCF-analyse was de behandeling met Namenda / donepezil statistisch significant beter dan placebo / donepezil.

Figuur 7: Tijdsverloop van de verandering van baseline in SIB-score voor patiënten die 24 weken van behandeling hebben voltooid.
Figuur 8 toont de cumulatieve percentages van patiënten uit elke behandelingsgroep die ten minste de mate van verbetering in SIB-score op de X-as hadden bereikt.
De curven laten zien dat beide patiënten toegewezen aan Namenda / donepezil en placebo / donepezil een breed bereik hebben van de reacties, maar dat de Namenda / donepezil-groep eerder een verbetering of een kleinere vertoont afwijzen.
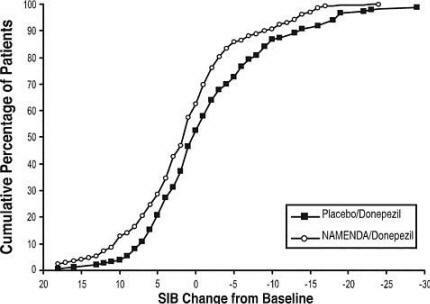
Figuur 8: Cumulatief percentage patiënten dat 24 weken dubbelblinde behandeling voltooit met gespecificeerde veranderingen ten opzichte van de uitgangssituatie in SIB-scores.
Onderzoek 3 (onderzoek van twaalf weken) In een dubbelblind onderzoek van 12 weken, uitgevoerd in verpleeghuizen in Letland, waren 166 patiënten met dementie volgens naar DSM-III-R, een Mini-Mental State Examen score van <10, en Global Deterioration Scale enscenering van 5 tot 7 werden gerandomiseerd naar Namenda of placebo. Voor patiënten gerandomiseerd naar Namenda werd de behandeling gestart met 5 mg eenmaal daags en verhoogd tot 10 mg eenmaal daags na 1 week. De primaire werkzaamheidsmaatregelen waren de zorgafhankelijkheidssubschaal van de Behavioral Rating Scale voor geriatrische patiënten (BGP), een maat voor de dagelijkse functie en een Clinical Global Impression of Change (CGI-C), een maat voor de algehele klinische effect. In dit onderzoek is geen geldige maat voor cognitieve functie gebruikt. Een statistisch significant behandelingsverschil na 12 weken dat Namenda begunstigde boven placebo werd gezien bij beide primaire werkzaamheidsmaatregelen. Omdat de ingevoerde patiënten een mengsel waren van de ziekte van Alzheimer en vasculaire dementie, werd een poging gedaan om de twee groepen en alle patiënten werden later aangewezen als vasculaire dementie of de ziekte van Alzheimer, op basis van hun scores op de Hachinski Ischemische schaal bij studie binnenkomst. Slechts ongeveer 50% van de patiënten had computertomografie van de hersenen. Voor de subset die werd aangemerkt als de ziekte van Alzheimer, werd een statistisch significant behandelingseffect waargenomen dat Namenda na 12 weken begunstigde boven placebo op zowel de BGP als de CGI-C.
Aanwijzingen en gebruik
Namenda (memantinehydrochloride) is geïndiceerd voor de behandeling van matige tot ernstige dementie van het type Alzheimer.
Contra
Namenda (memantinehydrochloride) is gecontra-indiceerd bij patiënten met bekende overgevoeligheid voor memantinehydrochloride of voor enige hulpstoffen die in de formulering worden gebruikt.
Voorzorgsmaatregelen
Informatie voor patiënten en zorgverleners: Zorgverleners moeten geïnstrueerd worden in de aanbevolen toediening (tweemaal per dag voor doses van meer dan 5 mg) en dosisescalatie (minimaal interval van één week tussen dosisverhogingen).
Neurologische aandoeningen Epileptische aanvallen:
Namenda is niet systematisch geëvalueerd bij patiënten met een epileptische aandoening. In klinische onderzoeken met Namenda kwamen aanvallen voor bij 0,2% van de patiënten die met Namenda werden behandeld en bij 0,5% van de patiënten die met placebo werden behandeld.
Geslachtsziekten
Omstandigheden die de pH van urine verhogen, kunnen de urinaire eliminatie van memantine verminderen, wat resulteert in verhoogde plasmaconcentraties van memantine.
Speciale populaties
Leverinsufficiëntie
Namenda ondergaat een gedeeltelijk levermetabolisme, waarbij ongeveer 48% van de toegediende dosis in de urine wordt uitgescheiden als onveranderd geneesmiddel of als de som van het oudergeneesmiddel en het N-glucuronide-conjugaat (74%). De farmacokinetiek van memantine bij patiënten met leverinsufficiëntie is niet onderzocht, maar zal naar verwachting slechts in geringe mate worden beïnvloed.
Nierinsufficiëntie
Er is geen dosisaanpassing nodig bij patiënten met milde of matige nierinsufficiëntie. Een dosisverlaging wordt aanbevolen bij patiënten met ernstige nierinsufficiëntie (zie KLINISCHE FARMACOLOGIE en DOSERING EN ADMINISTRATIE ).
Geneesmiddel-geneesmiddel interacties
N-methyl-D-aspartaat (NMDA) antagonisten: het gecombineerde gebruik van Namenda met andere NMDA-antagonisten (amantadine, ketamine en dextromethorphan) is niet systematisch geëvalueerd en een dergelijk gebruik moet met voorzichtigheid worden benaderd.
Effecten van Namenda op substraten van microsomale enzymen: In vitro-onderzoeken uitgevoerd met markersubstraten van CYP450-enzymen (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4) toonden minimale remming van deze enzymen door memantine. Bovendien geven in vitro-onderzoeken aan dat bij concentraties die hoger zijn dan die geassocieerd met de werkzaamheid, memantine niet de cytochroom P450-iso-enzymen CYP1A2, CYP2C9, CYP2E1 en CYP3A4 / 5 induceert. Er worden geen farmacokinetische interacties verwacht met geneesmiddelen die door deze enzymen worden gemetaboliseerd.
Effecten van remmers en / of substraten van microsomale enzymen op Namenda: Memantine wordt voornamelijk via de nier geëlimineerd en van geneesmiddelen die substraten en / of remmers van het CYP450-systeem zijn, wordt niet verwacht dat ze het metabolisme van memantine veranderen.
Acetylcholinesterase (AChE) -remmers: Gelijktijdige toediening van Namenda met de AChE-remmer donepezil HCl had geen invloed op de farmacokinetiek van beide verbindingen. In een 24 weken durende gecontroleerde klinische studie bij patiënten met matige tot ernstige ziekte van Alzheimer, de nadelige gevolgen het voorvalprofiel waargenomen met een combinatie van memantine en donepezil was vergelijkbaar met dat van alleen donepezil.
Geneesmiddelen geëlimineerd via niermechanismen: Omdat memantine gedeeltelijk wordt geëlimineerd door tubulaire secretie, gelijktijdige toediening van geneesmiddelen die hetzelfde nierkationische systeem gebruiken, waaronder hydrochloorthiazide (HCTZ), triamtereen (TA), metformine, cimetidine, ranitidine, kinidine en nicotine, kunnen mogelijk leiden tot veranderde plasmaconcentraties van beide agenten. Gelijktijdige toediening van Namenda en HCTZ / TA had echter geen invloed op de biologische beschikbaarheid van memantine of TA en de biologische beschikbaarheid van HCTZ daalde met 20%. Bovendien had gelijktijdige toediening van memantine met het antihyperglycemische geneesmiddel Glucovance® (glyburide en metformine HCl) geen invloed op de farmacokinetiek van memantine, metformine en glyburide. Bovendien heeft memantine het serumglucoseverlagende effect van Glucovance® niet gewijzigd.
Geneesmiddelen die de urine basisch maken: De klaring van memantine was verminderd met ongeveer 80% onder alkalische urine-omstandigheden bij pH 8. Daarom kunnen veranderingen van de pH van de urine in de richting van de alkalische toestand leiden tot een ophoping van het geneesmiddel met een mogelijke toename van bijwerkingen. De urine-pH wordt gewijzigd door voeding, geneesmiddelen (bijvoorbeeld koolzuuranhydraseremmers, natriumbicarbonaat) en de klinische toestand van de patiënt (bijvoorbeeld niertubulaire acidose of ernstige infecties van de urinewegen). Daarom moet memantine onder deze omstandigheden met voorzichtigheid worden gebruikt.
Carcinogenese, mutagenese en aantasting van de vruchtbaarheid
Er waren geen aanwijzingen voor carcinogeniteit in een 113 weken durende orale studie bij muizen bij doses tot 40 mg / kg / dag (10 maal de maximale aanbevolen humane dosis [MRHD] op basis van mg / m2). Er was ook geen bewijs van carcinogeniteit bij ratten die oraal werden gedoseerd tot 40 mg / kg / dag gedurende 71 weken gevolgd door 20 mg / kg / dag (20 en 10 maal de MRHD op basis van mg / m 2, respectievelijk) gedurende 128 weken.
Memantine produceerde geen bewijs van genotoxisch potentieel wanneer geëvalueerd in de in vitro S. typhimurium of E. coli reverse-mutatietest, een in vitro chromosomale aberratietest bij menselijke lymfocyten, een in vivo cytogenetica-test op chromosoomschade bij ratten en de in vivo micronucleustest bij muizen. De resultaten waren dubbelzinnig in een in vitro genmutatietest met behulp van Chinese hamster V79-cellen.
Er werd geen verslechtering van de vruchtbaarheid of reproductieve prestaties waargenomen bij ratten die werden toegediend tot 18 mg / kg / dag (9 maal de MRHD op een mg / m2 basis) oraal vanaf 14 dagen voorafgaand aan de paring door dracht en lactatie bij vrouwen, of gedurende 60 dagen voorafgaand aan de paring in mannetjes.
Zwangerschap
Zwangerschap Categorie B: Memantine dat oraal werd toegediend aan zwangere ratten en zwangere konijnen tijdens de periode van organogenese was niet teratogeen tot de hoogste geteste doses (18 mg / kg / dag bij ratten en 30 mg / kg / dag bij konijnen, respectievelijk 9 en 30 keer de maximale aanbevolen dosis voor mensen [MRHD] op een mg / m 2 basis).
Lichte maternale toxiciteit, verlaagd pupgewicht en een verhoogde incidentie van niet-verbeende halswervels werden waargenomen bij een orale dosis van 18 mg / kg / dag in een onderzoek waarin ratten orale memantine kregen, beginnend vóór de paring en voortgezet door het postpartum periode. Lichte maternale toxiciteit en afgenomen pupgewichten werden ook gezien bij deze dosis in een studie waarin ratten werden behandeld vanaf dag 15 van de zwangerschap tot de post-partum periode. De dosis zonder effect voor deze effecten was 6 mg / kg, wat driemaal de MRHD is op basis van mg / m2.
Er zijn geen adequate en goed gecontroleerde onderzoeken naar memantine bij zwangere vrouwen. Memantine mag alleen tijdens de zwangerschap worden gebruikt als het potentiële voordeel het potentiële risico voor de foetus rechtvaardigt.
Moeders die borstvoeding geven
Het is niet bekend of memantine wordt uitgescheiden in menselijke moedermelk. Omdat veel geneesmiddelen in moedermelk worden uitgescheiden, is voorzichtigheid geboden wanneer memantine wordt toegediend aan een moeder die borstvoeding geeft.
Gebruik bij kinderen
Er zijn geen adequate en goed gecontroleerde onderzoeken die de veiligheid en werkzaamheid van memantine bij elke ziekte die bij kinderen voorkomt, documenteren.
Bijwerkingen
De ervaring die in deze sectie wordt beschreven, is afkomstig van onderzoeken bij patiënten met de ziekte van Alzheimer en vasculaire dementie.
Bijwerkingen die leiden tot stopzetting: In placebogecontroleerde onderzoeken waarbij dementiepatiënten doses Namenda tot 20 mg / dag kregen, de de waarschijnlijkheid van stopzetting vanwege een bijwerking was hetzelfde in de Namenda-groep als in de placebo groep. Geen individuele bijwerking werd geassocieerd met de stopzetting van de behandeling bij 1% of meer van met Namenda behandelde patiënten en in een tempo hoger dan placebo.
Bijwerkingen gemeld in gecontroleerde onderzoeken: De gerapporteerde bijwerkingen in Namenda-onderzoeken (memantinehydrochloride) weerspiegelen de ervaring die is opgedaan onder nauwlettend gecontroleerde omstandigheden in een zeer geselecteerde patiëntenpopulatie. In de praktijk of in andere klinische onderzoeken zijn deze frequentieschattingen mogelijk niet van toepassing, omdat de gebruiksvoorwaarden, het meldgedrag en de soorten behandelde patiënten kunnen verschillen. Tabel 1 geeft een lijst van behandelingsgerelateerde tekenen en symptomen die werden gemeld bij ten minste 2% van de patiënten in placebogecontroleerde dementiestudies en waarbij het aantal gevallen groter was voor patiënten die met Namenda werden behandeld dan voor patiënten die werden behandeld placebo. Er is geen bijwerking opgetreden met een frequentie van ten minste 5% en tweemaal het placebo-percentage.
Lichaamssysteem |
Placebo (N = 922) % |
Namenda (N = 940) % |
Lichaam als een geheel | ||
Vermoeidheid |
1 | 2 |
Pijn |
1 | 3 |
Cardiovasculair systeem | ||
hypertensie |
2 | 4 |
Centraal en perifeer zenuwstelsel | ||
Duizeligheid |
5 | 7 |
Hoofdpijn |
3 | 6 |
Maagdarmstelsel | ||
Constipatie |
3 | 5 |
braken |
2 | 3 |
Musculoskeletaal systeem | ||
Rugpijn |
2 | 3 |
Psychiatrische stoornissen | ||
Verwarring |
5 | 6 |
Slaperigheid |
2 | 3 |
Hallucinatie |
2 | 3 |
Luchtwegen | ||
hoesten |
3 | 4 |
kortademigheid |
1 | 2 |
Andere bijwerkingen die zich voordeden met een incidentie van ten minste 2% bij met Namenda behandelde patiënten, maar met een groter of gelijk percentage bij placebo waren agitatie, val, toegebracht letsel, urine-incontinentie, diarree, bronchitis, slapeloosheid, urineweginfectie, griepachtige symptomen, abnormaal looppatroon, depressie, infectie van de bovenste luchtwegen, angst, perifeer oedeem, misselijkheid, anorexia en gewrichtspijn.
Het algemene profiel van bijwerkingen en de incidentiepercentages voor individuele bijwerkingen in de subpopulatie van patiënten met matige tot ernstige ziekte van Alzheimer waren niet verschillend van het profiel en de incidentiecijfers hierboven beschreven voor de algehele dementie bevolking.
Wijzigingen in vitale functies: Namenda- en placebogroepen werden vergeleken met betrekking tot (1) gemiddelde verandering van baseline in vitale functies (pols, systolische bloeddruk, diastolisch bloed druk en gewicht) en (2) de incidentie van patiënten die voldoen aan criteria voor potentieel klinisch significante veranderingen ten opzichte van de uitgangswaarde hierin variabelen. Er waren geen klinisch belangrijke veranderingen in vitale functies bij patiënten die met Namenda werden behandeld. Een vergelijking van liggende en staande vitale maatregelen voor Namenda en placebo bij oudere normale proefpersonen gaf aan dat behandeling met Namenda niet geassocieerd is met orthostatische veranderingen.
Laboratoriumveranderingen: Namenda- en placebogroepen werden vergeleken met betrekking tot (1) gemiddelde verandering ten opzichte van de uitgangswaarde in verschillende serumchemie, hematologie en urinevariabelen en (2) de incidentie van patiënten die voldoen aan criteria voor potentieel klinisch significante veranderingen ten opzichte van de uitgangswaarde hierin variabelen. Deze analyses onthulden geen klinisch belangrijke veranderingen in laboratoriumtestparameters geassocieerd met de behandeling met Namenda.
ECG-wijzigingen: Namenda- en placebogroepen werden vergeleken met betrekking tot (1) gemiddelde verandering ten opzichte van de uitgangswaarde in verschillende ECG-parameters en (2) de incidentie van patiënten die voldoen aan criteria voor potentieel klinisch significante veranderingen ten opzichte van de uitgangswaarde hierin variabelen. Deze analyses onthulden geen klinisch belangrijke veranderingen in ECG-parameters geassocieerd met de behandeling met Namenda.
Andere bijwerkingen die zijn waargenomen tijdens klinische onderzoeken
Namenda is toegediend aan ongeveer 1350 patiënten met dementie, van wie meer dan 1200 de maximale aanbevolen dosis van 20 mg / dag kreeg. Patiënten ontvingen een behandeling met Namenda voor een periode van maximaal 884 dagen, waarbij 862 patiënten ten minste 24 weken behandeling kregen en 387 patiënten 48 weken of meer behandeling kregen.
Tijdens de behandeling optredende tekenen en symptomen die zich voordeden tijdens 8 gecontroleerde klinische onderzoeken en 4 open-label proeven werden geregistreerd als bijwerkingen door de klinische onderzoekers met behulp van hun eigen terminologie kiezen. Om een algemene schatting te geven van het aandeel personen met vergelijkbare soorten evenementen, werden de evenementen gegroepeerd in een kleiner aantal gestandaardiseerde categorieën met behulp van WHO-terminologie, en gebeurtenisfrequenties werden voor alle berekend studies.
Alle bijwerkingen die optreden bij ten minste twee patiënten zijn inbegrepen, behalve die welke al in tabel 1 zijn vermeld, ook in de WHO-termen algemeen informatief, kleine symptomen of gebeurtenissen die waarschijnlijk niet door geneesmiddelen worden veroorzaakt, bijvoorbeeld omdat ze veel voorkomen in de studie bevolking. Gebeurtenissen worden geclassificeerd per lichaamssysteem en weergegeven met behulp van de volgende definities: frequente bijwerkingen - die zich voordoen bij ten minste 1/100 patiënten; zelden voorkomende bijwerkingen - die zich voordoen bij 1/100 tot 1/1000 patiënten. Deze bijwerkingen zijn niet noodzakelijkerwijs gerelateerd aan de behandeling met Namenda en werden in de gecontroleerde gevallen in de meeste gevallen met een vergelijkbare frequentie waargenomen bij met placebo behandelde patiënten.
Lichaam als een geheel: Frequent: syncope. Onregelmatig: hypothermie, allergische reactie.
Cardiovasculair systeem: Frequent: hartfalen. Onregelmatig: angina pectoris, bradycardie, myocardinfarct, tromboflebitis, atriumfibrilleren, hypotensie, hartstilstand, orthostatische hypotensie, longembolie, longoedeem.
Centraal en perifeer zenuwstelsel: Frequent: voorbijgaande ischemische aanval, cerebrovasculair accident, duizeligheid, ataxie, hypokinesie. Onregelmatig: paresthesie, convulsies, extrapiramidale aandoening, hypertonie, tremor, afasie, hypo-esthesie, abnormaal coördinatie, hemiplegie, hyperkinesie, onwillekeurige spiercontracties, stupor, hersenbloeding, neuralgie, ptosis, neuropathie.
Maagdarmstelsel: Niet vaak: gastro-enteritis, diverticulitis, gastro-intestinale bloeding, melena, slokdarmzweer.
Hemische en lymfatische aandoeningen: Frequent: bloedarmoede. Onregelmatig: leukopenie.
Metabole en voedingsstoornissen: Frequent: verhoogde alkalische fosfatase, verlaagd gewicht. Onregelmatig: uitdroging, hyponatriëmie, verergerde diabetes mellitus.
Psychiatrische stoornissen: Frequent: agressieve reactie. Onregelmatig: waanideeën, persoonlijkheidsstoornis, emotionele labiliteit, nervositeit, slaapstoornis, verhoogd libido, psychose, geheugenverlies, apathie, paranoïde reactie, abnormaal denken, abnormaal huilen, verhoogde eetlust, paroniria, delirium, depersonalisatie, neurose, zelfmoord poging.
Luchtwegen: Frequent: longontsteking. Onregelmatig: apneu, astma, hemoptyse.
Huid en aanhangsels: Frequent: uitslag. Onregelmatig: huidzweren, jeuk, cellulitis, eczeem, dermatitis, erythemateuze uitslag, alopecia, urticaria.
Speciale zintuigen: Frequent: cataract, conjunctivitis. Onregelmatig: macula lutea degeneratie, verminderde gezichtsscherpte, verminderd gehoor, tinnitus, blefaritis, wazig zien, opaciteit van het hoornvlies, glaucoom, conjunctivale bloeding, oogpijn, retinale bloeding, xeroftalmie, diplopie, abnormale traanafscheiding, bijziendheid, netvliesloslating.
Urinewegen: Frequent: frequente mictie. Onregelmatig: dysurie, hematurie, urineretentie.
Gebeurtenissen gerapporteerd na de marketing van Namenda, zowel in de VS als in de VS
Hoewel er geen causaal verband is gevonden met de behandeling met memantine, is gemeld dat de volgende bijwerkingen tijdelijk verband houden met de behandeling met memantine en niet elders in de etikettering beschreven: atrioventriculair blok, botbreuk, carpaal tunnelsyndroom, herseninfarct, pijn op de borst, claudicatie, colitis, dyskinesie, dysfagie, gastritis, gastro-oesofageale reflux, grand mal convulsies, intracraniële bloeding, leverfalen, hyperlipidemie, hypoglykemie, ileus, impotentie, malaise, maligne neuroleptisch syndroom, acuut pancreatitis, aspiratiepneumonie, acuut nierfalen, verlengd QT-interval, rusteloosheid, Stevens-Johnson-syndroom, plotselinge dood, supraventriculaire tachycardie, tachycardie, tardief dyskinesie en trombocytopenie.
DIERLIJKE TOXICOLOGIE
Memantine veroorzaakte neuronale laesies (vacuolatie en necrose) in de multipolaire en piramidale cellen in corticale lagen III en IV van het achterste cingulaat en retrospleniale neocortices bij ratten, vergelijkbaar met die waarvan bekend is dat ze voorkomen bij knaagdieren waaraan andere NMDA-receptorantagonisten worden toegediend. Laesies werden waargenomen na een enkele dosis memantine. In een onderzoek waarin ratten gedurende 14 dagen dagelijkse orale doses memantine kregen, was de dosis zonder effect voor neuronale necrose 6 maal de maximale aanbevolen dosis voor mensen op basis van mg / m2. Het potentieel voor inductie van centrale neuronale vacuolatie en necrose door NMDA-receptorantagonisten bij mensen is onbekend.
MISBRUIK EN AFHANKELIJKHEID
Gecontroleerde stofklasse: Memantine HCl is geen gereguleerde stof.
Lichamelijke en psychologische afhankelijkheid: Memantine HCl is een niet-competitieve NMDA-antagonist met lage tot matige affiniteit die geen bewijs leverde van het zoeken naar geneesmiddelen gedrag of ontwenningsverschijnselen bij stopzetting bij 2.504 patiënten die aan therapeutische onderzoeken hebben deelgenomen aan klinische onderzoeken doses. Postmarketinggegevens, buiten de VS, achteraf verzameld, hebben geen bewijs van drugsmisbruik of -afhankelijkheid opgeleverd.
Overdose
Omdat strategieën voor het beheer van overdosering voortdurend evolueren, is het raadzaam om contact op te nemen met a centrum voor gifcontrole om de nieuwste aanbevelingen voor het beheer van een overdosis te bepalen drug.
Zoals in alle gevallen van overdosering, moeten algemene ondersteunende maatregelen worden genomen en moet de behandeling symptomatisch zijn. De eliminatie van memantine kan worden verbeterd door verzuring van urine. In een gedocumenteerd geval van een overdosis met maximaal 400 mg memantine, ervoer de patiënt rusteloosheid, psychose, visuele hallucinaties, slaperigheid, verdoving en bewustzijnsverlies. De patiënt herstelde zonder permanente gevolgen.
Dosering en administratie
De dosering van Namenda (memantinehydrochloride) waarvan is aangetoond dat het effectief is in gecontroleerde klinische onderzoeken is 20 mg / dag.
De aanbevolen startdosis Namenda is eenmaal daags 5 mg. De aanbevolen doeldosis is 20 mg / dag. De dosis moet worden verhoogd in stappen van 5 mg tot 10 mg / dag (5 mg tweemaal daags), 15 mg / dag (5 mg en 10 mg als afzonderlijke doses) en 20 mg / dag (10 mg tweemaal daags). Het minimale aanbevolen interval tussen dosisverhogingen is één week.
Namenda kan met of zonder voedsel worden ingenomen.
Patiënten / zorgverleners moeten worden geïnstrueerd over het gebruik van het Namenda-doseersysteem voor orale oplossingen. Ze moeten bewust worden gemaakt van het instructieblad voor de patiënt dat bij het product is gevoegd. Patiënten / zorgverleners moeten worden geïnstrueerd om eventuele vragen over het gebruik van de oplossing aan hun arts of apotheker te stellen.
Doses in speciale populaties
Een streefdosis van 5 mg tweemaal daags wordt aanbevolen bij patiënten met ernstige nierinsufficiëntie (creatinineklaring van 5 - 29 ml / min op basis van de Cockroft-Gault-vergelijking):
Voor mannen: CLcr = [140-leeftijd (jaren)] · Gewicht (kg) / [72 · serumcreatinine (mg / dL)]
Voor vrouwen: CLcr = 0,85 · [140-leeftijd (jaren)] · Gewicht (kg) / [72 · serumcreatinine (mg / dL)]
Hoe geleverd
5 mg tablet:
Fles van 60 NDC # 0456-3205-60
10 - 10 Eenheidsdosis NDC # 0456-3205-63
De capsulevormige, filmomhulde tabletten zijn geelbruin, met aan één zijde de sterkte (5) en aan de andere zijde FL.
10 mg tablet:
Fles van 60 NDC # 0456-3210-60
10 - 10 Eenheidsdosis NDC # 0456-3210-63
De capsulevormige, filmomhulde tabletten zijn grijs, met aan de ene kant de sterkte (10) en aan de andere kant FL.
Titratie Pak:
PVC / aluminium blisterverpakking met 49 tabletten. 28 - 5 mg en 21 - 10 mg tabletten. NDC # 0456-3200-14
De capsulevormige, filmomhulde tabletten van 5 mg zijn geelbruin, met aan één zijde de sterkte (5) en aan de andere zijde FL. De capsulevormige, filmomhulde tabletten van 10 mg zijn grijs, met aan de ene kant de sterkte (10) en aan de andere kant FL.
Orale oplossing:
De doseringsaanbevelingen voor drank zijn dezelfde als die voor tabletten. De drank is helder, alcoholvrij, suikervrij en met pepermuntsmaak.
2 mg / ml orale oplossing (10 mg = 5 ml)
12 fl. oz. (360 ml) fles NDC # 0456-3202-12
Bewaren bij 25 ° C (77 ° F); excursies toegestaan tot 15-30 ° C (59-86 ° F) [zie USP Gecontroleerde kamertemperatuur].
Forest Pharmaceuticals, Inc.
Dochteronderneming van Forest Laboratories, Inc.
St. Louis, MO 63045
Onder licentie van Merz Pharmaceuticals GmbH
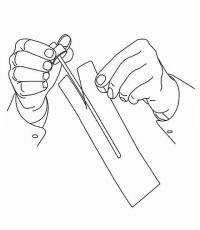
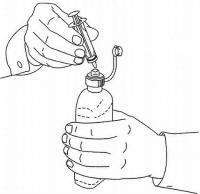
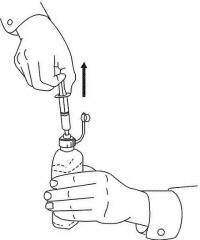
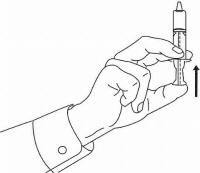
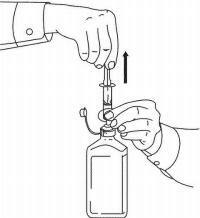
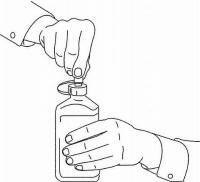
PATIËNTINSTRUCTIES VOOR NAMENDA® orale oplossing
Volg de onderstaande aanwijzingen om uw Namenda®-doseersysteem voor orale oplossing te gebruiken.
BELANGRIJK: lees deze instructies voordat u Namenda® orale oplossing gebruikt.
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
BELANGRIJK: De informatie in deze monografie is niet bedoeld om alle mogelijke toepassingen, aanwijzingen, voorzorgsmaatregelen, interacties tussen geneesmiddelen of bijwerkingen te dekken. Deze informatie is algemeen en is niet bedoeld als specifiek medisch advies. Neem contact op met uw arts, apotheker of verpleegkundige als u vragen heeft over de medicijnen die u gebruikt of meer informatie wilt. Laatst bijgewerkt op 4/07.
Bron: Forest Laboratories, Amerikaanse distributeur van Namenda.
Namenda-patiëntinformatie (in gewoon Engels)
terug naar: Psychiatrische medicijnen Farmacologie Homepage


